Морфофункциональные особенности диафрагмы у больных с хронической сердечной недостаточностью | Арутюнов
1. Elliott J.E., Greising S.M., Mantilla C.B., Sieck G.C. Functional impact of sarcopenia in respiratory muscles. Respir Physiol Neurobiol 2015 DOI: 10.1016/j.resp.2015.10.001.
2. Cacciani N., Ogilvie H., Larsson L. Age related differences in diaphragm muscle fiber response to mid/long term controlled mechanical ventilation. Exp Gerontol 2014;59:28–33. DOI: 10.1016/j.exger.2014.06.017.
3. Sieck G.C., Ferreira L.F., Reid M.B., Mantilla C.B. Mechanical properties of respiratory muscles. Compr Physiol 2013;3(4):1553– 1567. DOI: 10.1002/cphy.c130003.
4. Hooijman P.E., Beishuizen A., Witt C.C. et al. Diaphragm muscle fiber weakness and ubiquitin-proteasome activation in critically ill patients. Am J Respir Crit Care Med 2015;191(10):1126–1138. DOI: 10.1164/rccm.201412-2214OC.
5. Lindsay D.C., Lovegrove C.A., Dunn M.J. et al. Histological abnormalities of muscle from limb, thorax and diaphragm in chronic heart failure. Eur Heart J 1996;17(8):1239–1250.
Eur Heart J 1996;17(8):1239–1250.
6. Stassijns G., Lysens R., Decramer M. Peripheral and respiratory muscles in chronic heart failure. Eur Respir J 1996;9(10):2161–2167.
7. Kinugawa S., Takada S., Matsushima S. et al. Skeletal muscle abnormalities in heart failure. Int Heart J 2015;56:475–484.
8. Arutyunov A. G., Rylova A. K., Arutyunov G. P. The register of hospitalized patients with circulatory decompensation (Pavlovsky register). First report. Modern clinical characteristics of patients with circulatory decompensation. Clinical phenotypes of patients. Heart Failure J 2014;15;1(82):23–32. Russian (Арутюнов А. Г., Рылова А. К., Арутюнов Г. П. Регистр госпитализированных пациентов с декомпенсацией кровообращения (Павловский регистр). Сообщение 1. Современная клиническая характеристика пациента с декомпенсацией кровообращения. Клинические фенотипы пациентов. Журнал Сердечная недостаточность 2014;15;1(82):23–32.)
9. Lung function testing: selection of reference values and interpretative strategies. American Thoracic Society. Am Rev Respir Dis 1991;144:1202–1218.
American Thoracic Society. Am Rev Respir Dis 1991;144:1202–1218.
10. ATS/ERS Statement on respiratory muscle testing. Am J Respir Crit Care Med. 2002;166:518–624.
11. Black L.F., Hyatt R.E. Maximal respiratory pressures: normal values and relationship to age and sex. Am Rev Respir Dis 1969;99:696–702.
12. Obando L.M.G., López A.L., Ávila C.L. Normal values of the maximal respiratory pressures in healthy people older than 20 years old in the City of Manizales – Colombia Colomb Med (Cali) 2012;43(2):119–125.
13. Steier J., Kaul S., Seymour J. et al. The value of multiple tests of respiratory muscle strength. Thorax 2007;62(11):975–980. DOI: 10.1136/thx.2006.072884.
14. Enright P.L., Adams A.B., Boyle P.J., Sherrill D.L. Spirometry and maximal respiratory pressure references from healthy Minnesota 65- to 85-year-old women and men. Chest 1995;108(3):663–669.
15. Enright P.L., Kronmal R.A., Manolio T.A. et al. Respiratory muscle strength in the elderly. Correlates and reference values. Cardiovascular Health Study Research Group. Am J Respir Crit Care Med 1994;149(2 Pt 1):430–438. DOI: 10.1164/ajrccm.149.2.8306041.
Cardiovascular Health Study Research Group. Am J Respir Crit Care Med 1994;149(2 Pt 1):430–438. DOI: 10.1164/ajrccm.149.2.8306041.
16. Tolep K., Higgins N., Muza S. et al. Comparison of diaphragm strength between healthy adult elderly and young men. Am J Respir Crit Care Med 1995;152(2):677–682. DOI: 10.1164/ajrccm.152.2.7633725.
17. Dall’ago P., Chiappa G.R., Guths H. et al. Inspiratory muscle training in patients with heart failure and inspiratory muscle weakness: a randomized trial. J Am Coll Cardiol 2006;47(4):757–763.
18. Ribeiro J.P., Chiappa G.R., Neder J.A., Frankenstein L. Respiratory muscle function and exercise intolerance in heart failure. Curr Heart Fail Rep 2009;6(2):95–101.
19. Tager T., Schell M., Cebola R. et al. Biological variation, reference change value (RCV) and minimal important difference (MID) of inspiratory muscle strength (PImax) in patients with stable chronic heart failure. Clin Res Cardiol 2015;104(10):822–830. DOI: 10.1007/s00392-015-0850-3.
20. Yamada K., Kinugasa Y., Sota T. et al. Inspiratory Muscle Weakness is Associated With Exercise Intolerance in Patients With Heart Failure With Preserved Ejection Fraction: A Preliminary Study. J Card Fail 2016;22(1):38–47. DOI: 10.1016/j.cardfail.2015.10.010.
21. Mancini D.M., Henson D., LaManca J., Levine S. Respiratory muscle function and dyspnea in patients with chronic congestive heart failure. Circulation 1992;86 (3):909–918.
22. Manning H.L., Schwartzstein R.M. Pathophysiology of dyspnea. N Engl J Med 1995;333(23):1547–1553.
23. Woods P.R., Olson T.P., Frantz R.P., Johnson B.D. Causes of breathing inefficiency during exercise in heart failure. J Card Fail 2010;16(10):835–842. DOI: 10.1016/j.cardfail.2010.05.003.S1071-9164(10)00209-5 [pii]
24. Ponikowski P., Francis D.P., Piepoli M.F. et al. Enhanced ventilatory response to exercise in patients with chronic heart failure and preserved exercise tolerance: marker of abnormal cardiorespiratory reflex control and predictor of poor prognosis. Circulation 2001;103 (7):967–972.
Circulation 2001;103 (7):967–972.
25. Mor A., Thomsen R.W., Ulrichsen S.P., Sorensen H.T. Chronic heart failure and risk of hospitalization with pneumonia: a population-based study. Eur J Intern Med 2013;24(4):349–353. DOI: 10.1016/j.ejim.2013.02.013.S0953-6205(13)00079-4 [pii]
26. Cahalin L.P., Arena R., Guazzi M. et al. Inspiratory muscle training in heart disease and heart failure: a review of the literature with a focus on method of training and outcomes. Expert Rev Cardiovasc Ther 2013;11(2):161–177. DOI: 10.1586/erc.12.191.
27. Kawauchi T.S., Umeda II.K., Braga L.M. et al. Is there any benefit using low-intensity inspiratory and peripheral muscle training in heart failure? A randomized clinical trial. Clin Res Cardiol 2017;106(9):676–685. DOI: 10.1007/s00392-017-1089-y
28. Souza H., Rocha T., Pessoa M. et al. Effects of inspiratory muscle training in elderly women on respiratory muscle strength, diaphragm thickness and mobility. J Gerontol A Biol Sci Med Sci 2014;69(12):1545–1553. DOI: 10.1093/gerona/glu182.
DOI: 10.1093/gerona/glu182.
Диафрагма: связь регуляции кровоснабжения с особенностями сократительной функции | Борзых
1. Fogarty M.J., Sieck G.C. Evolution and functional differentiation of the diaphragm muscle of mammals // Compr. Physiol. 2019. Vol. 9. N 2. P. 715–766.
2. Manohar M. Costal vs. crural diaphragmatic blood flow during submaximal and near-maximal exercise in ponies // J. Appl. Physiol. 1988. Vol. 65. N 4. P. 1514–1519.
3. Kirkton S.D., Howlett R.A., Gonzalez N.C., Giuliano P.G., Britton S.L., Koch L.G., Wagner H.E., Wagner P.D. Continued artificial selection for running endurance in rats is associated with improved lung function // J. Appl. Physiol. 2009. Vol. 106. N 6. P. 1810–1818.
4. Rosser-Stanford B., Backx K., Lord R., Williams E.M. Static and dynamic lung volumes in swimmers and their ventilatory response to maximal exercise // Lung. 2019. Vol. 197. N 1. P. 15–19.
5. Neder J.A., Dal Corso S., Malaguti C., Reis S., De Fuccio M. B., Schmidt H., Fuld J.P., Nery L.E. The pattern and timing of breathing during incremental exercise: A normative study // Eur. Respir. J. 2003. Vol. 21. N 3. P. 530–538.
B., Schmidt H., Fuld J.P., Nery L.E. The pattern and timing of breathing during incremental exercise: A normative study // Eur. Respir. J. 2003. Vol. 21. N 3. P. 530–538.
6. Fogarty M.J., Mantilla C.B., Sieck G.C. Breathing: Motor control of diaphragm muscle // Physiology (Bethesda). 2018. Vol. 33. N 2. P. 113–126.
7. Schiaffino S., Reggiani C. Fiber types in mammalian skeletal muscles // Physiol. Rev. 2011. Vol. 91. N 4. P. 1447–1531.
8. Schiaffino S., Sandri M., Murgia M. Activitydependent signaling pathways controlling muscle diversity and plasticity // Physiology (Bethesda). 2007. Vol. 22. N 4. P. 269–278.
9. Bloemberg D., Quadrilatero J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis // PLoS One. 2012. Vol. 7. N 4: e35273.
10. Delp M.D., Duan C. Composition and size of type I, IIA, IID/X, and IIB fibers and citrate synthase activity of rat muscle // J. Appl. Physiol. 1996. Vol. 80. N 1. P. 261–270.
1996. Vol. 80. N 1. P. 261–270.
11. Тарасова О.С., Каленчук В.У., Борзых А.А., Андреев-Андриевский А.А, Буравков С.В., Шарова А.П., Виноградова О.Л. Сравнение вазомоторных реакций и иннервации мелких артерий локомоторной и дыхательной мускулатуры у крыс // Биофизика. 2008. Т. 53. №. 6. С. 1095–1102.
12. Borzykh A.A., Andreev-Andrievskiy A.A., Kalenchuk V.U., Mochalov S.V., Buravkov S.V., Kuzmin I.V., Borovik A.S., Vinogradova O.L., Tarasova O.S. Strategies of adaptation of small arteries in diaphragm and gastrocnemius muscle to aerobic exercise training // Hum. Physiol. 2017. Vol. 43. N 4. P. 437–445.
13. Metzger J.M., Scheidt K.B., Fitts R.H. Histochemical and physiological characteristics of the rat diaphragm // J. Appl. Physiol. 1985. Vol. 58. N 4. P. 1085–1091.
14. Борзых А.А., Гайнуллина Д.К., Кузьмин И.В., Шарова А.П., Тарасова О.С., Виноградова О.Л. Сравнительный анализ экспрессии генов в локомоторных мышцах и диафрагме крысы // Рос. физиол. журн. им. И.М. Сеченова. 2012. Т. 98. № 12. С. 1587–1594.
Сеченова. 2012. Т. 98. № 12. С. 1587–1594.
15. Uribe J.M., Stump C.S., Tipton C.M., Fregosi R.F. Influence of exercise training on the oxidative capacity of rat abdominal muscles // Respir. Physiol. 1992. Vol. 88. N 1–2. P. 171–180.
16. Metzger J.M., Fitts R.H. Contractile and biochemical properties of diaphragm: effects of exercise training and fatigue // J. Appl. Physiol. 1986. Vol. 60. N 5. P. 1752–1758.
17. Popov D.V. Adaptation of skeletal muscles to contractile activity of varying duration and intensity: the role of PGC-1α // Biochemistry (Moscow). 2018. Vol. 83. N 6. P. 613–628.
18. Suzuki J. Microvascular remodelling after endurance training with Co 2+ treatment in the rat diaphragm and hindleg muscles // Jpn. J. Physiol. 2002. Vol. 52. N 5. P. 409–419.
19. Gute D., Fraga C., Laughlin M.H., Amann J.F. Regional changes in capillary supply in skeletal muscle of high-intensity endurance-trained rats // J. Appl. Physiol. 1996. Vol. 81. N 2. P. 619–626.
20. Green H.J., Plyley M.J., Smith D.M., Kile J.G. Extreme endurance training and fiber type adaptation in rat diaphragm // J. Appl. Physiol. 1989. Vol. 66. N 4. P. 1914–1920.
21. Gosselin L.E., Betlach M., Vailas A.C., Thomas D.P. Training-induced alterations in young and senescent rat diaphragm muscle // J. Appl. Physiol. 1992. Vol. 72. N 4. P. 1506–1511.
22. Domínguez-Álvarez M., Gea J., Barreiro E. Inflammatory events and oxidant production in the diaphragm, gastrocnemius, and blood of rats exposed to chronic intermittent hypoxia: therapeutic strategies // J. Cell. Physiol. 2017. Vol. 232. N 5. P. 1165–1175.
23. Armstrong R.B., Laughlin M.H. Metabolic indicators of fibre recruitment in mammalian muscles during locomotion // J. Exp. Biol. 1985. Vol. 115. P. 201–213.
24. Joyner M.J., Casey D.P. Regulation of increased blood flow (Hyperemia) to muscles during exercise: A hierarchy of competing physiological needs // Physiol. Rev. 2015. Vol. 95. N 2. P. 549–601.
25. Murrant C.L., Sarelius I.H. Local control of blood flow during active hyperaemia: What kinds of integration are important? // J. Physiol. 2015. Vol. 593. N 21. P. 4699–4711.
26. Sexton W.L., Poole D.C. Costal diaphragm blood flow heterogeneity at rest and during exercise // Respir. Physiol. 1995. Vol. 101. N 2. P. 171–182.
27. Laughlin M.H., Armstrong R.B. Rat muscle blood flows as a function of time during prolonged slow treadmill exercise // Am. J. Physiol. 1983. Vol. 244. N 6. P. H814–824.
28. Sarelius I., Pohl U. Control of muscle blood flow during exercise: local factors and integrative mechanisms // Acta Physiol. (Oxf.). 2010. Vol. 199. N 4. P. 349–365.
29. Bagher P., Segal S.S. Regulation of blood flow in the microcirculation: Role of conducted vasodilation // Acta Physiologica. 2011. Vol. 202. N 3. P. 271–284.
30. Мелькумянц А.М. О роли эндотелиального гликокаликса в механогенной регуляции сопротивления артериальных сосудов // Успехи физиол.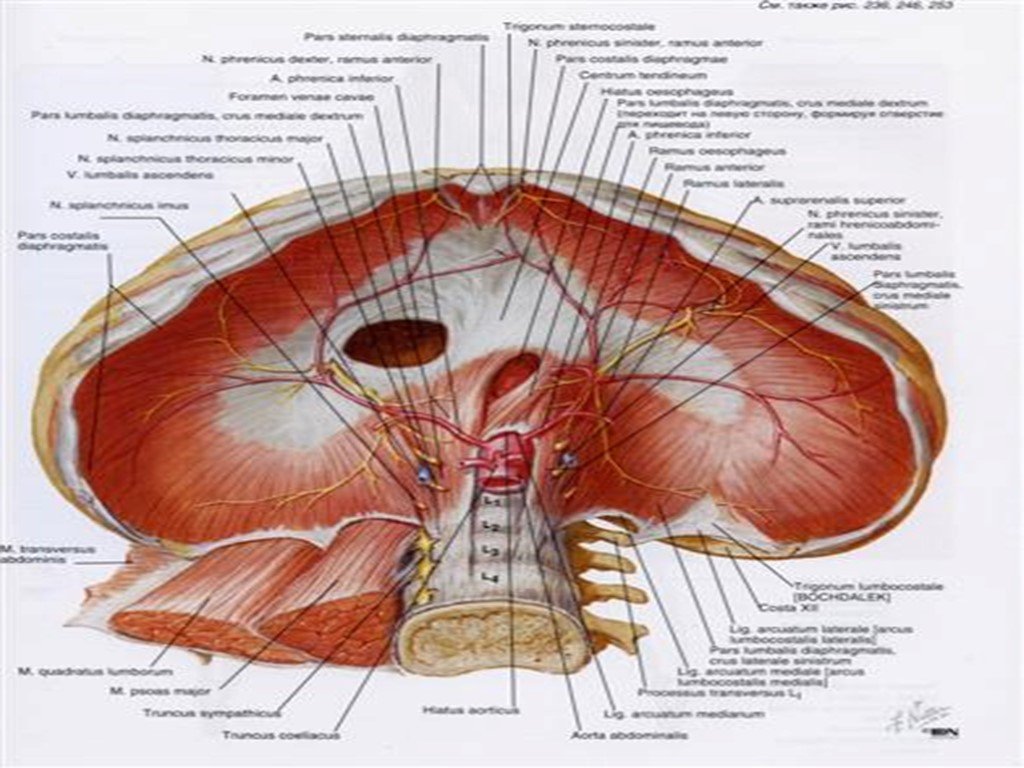 наук. 2012. Т. 43. № 4. С. 45–58.
наук. 2012. Т. 43. № 4. С. 45–58.
31. Fixler D.E., Atkins J.M., Mitchell J.H., Horwitz L.D. Blood flow to respiratory, cardiac, and limb muscles in dogs during graded exercise // Am. J. Physiol. 1976. Vol. 231. N 5. P. 1515–1519.
32. Manohar M. Inspiratory and expiratory muscle perfusion in maximally exercised ponies // J. Appl. Physiol. 1990. Vol. 68. N 2. P. 544–548.
33. Nobrega A.C.L., O’Leary D., Silva B.M., Marongiu E., Piepoli M.F., Crisafulli A. Neural regulation of cardiovascular response to exercise: role of central command and peripheral afferents // Biomed Res. Int. 2014. Vol. 2014. P. 478965.
34. O’Leary D.S., Robinson E.D., Butler J.L. Is active skeletal muscle functionally vasoconstricted during dynamic exercise in conscious dogs? // Am. J. Physiol. 1997. Vol. 272. N 1. P. R386–R391.
35. Manohar M. Vasodilator reserve in respiratory muscles during maximal exertion in ponies // J. Appl. Physiol (1985). 1986. Vol. 60. N 5. P. 1571–1577.
36. Sheel A.W., Boushel R., Dempsey J.A. Competition for blood flow distribution between respiratory and locomotor muscles: Implications for muscle fatigue // J. Appl. Physiol. 2018. Vol. 125. N 3. P. 820–831.
Sheel A.W., Boushel R., Dempsey J.A. Competition for blood flow distribution between respiratory and locomotor muscles: Implications for muscle fatigue // J. Appl. Physiol. 2018. Vol. 125. N 3. P. 820–831.
37. Dempsey J.A., Romer L., Rodman J., Miller J., Smith C. Consequences of exercise-induced respiratory muscle work // Respir. Physiol. Neurobiol. 2006. Vol. 151. N 2–3. P. 242–250.
38. Laughlin M.H., Armstrong R.B. Adrenoreceptor effects on rat muscle blood flow during treadmill exercise // J. Appl. Physiol. 1987. Vol. 62. N 4. P. 1465–1472.
39. Behnke B.J., Armstrong R.B., Delp M.D. Adrenergic control of vascular resistance varies in muscles composed of different fiber types: Influence of the vascular endothelium // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2011. Vol. 301. N 3. P. R783–R790.
40. Hilton S.M., Jeffries M.G., Vrbová G. Functional specializations of the vascular bed of soleus // J. Physiol. 1970. Vol. 206. N 3. P. 543–562.
41. Aaker A. , Laughlin M.H. Diaphragm arterioles are less responsive to alpha1-adrenergic constriction than gastrocnemius arterioles // J. Appl. Physiol. 2002. Vol. 92. N 5. P. 1808–1816.
, Laughlin M.H. Diaphragm arterioles are less responsive to alpha1-adrenergic constriction than gastrocnemius arterioles // J. Appl. Physiol. 2002. Vol. 92. N 5. P. 1808–1816.
42. Laughlin M.H., Woodman C.R., Schrage W.G., Gute D., Price E.M. Interval sprint training enhances endothelial function and eNOS content in some arteries that perfuse white gastrocnemius muscle // J. Appl. Physiol. 2004. Vol. 96. N 1. P. 233–244.
43. Van Teeffelen J.W.G.E., Segal S.S. Interaction between sympathetic nerve activation and muscle fibre contraction in resistance vessels of hamster retractor muscle // J Physiol. 2003. Vol. 550. N. 2. P. 563–574.
44. McCurdy M.R., Colleran P.N., Muller-Delp J., Delp M.D. Effects of fiber composition and hindlimb unloading on the vasodilator properties of skeletal muscle arterioles // J. Appl. Physiol. 2000. Vol. 89. N 1. P. 398–405.
45. Schwartz L.M., McKenzie J.E. Adenosine and active hyperemia in soleus and gracilis muscle of cats // Am. J. Physiol.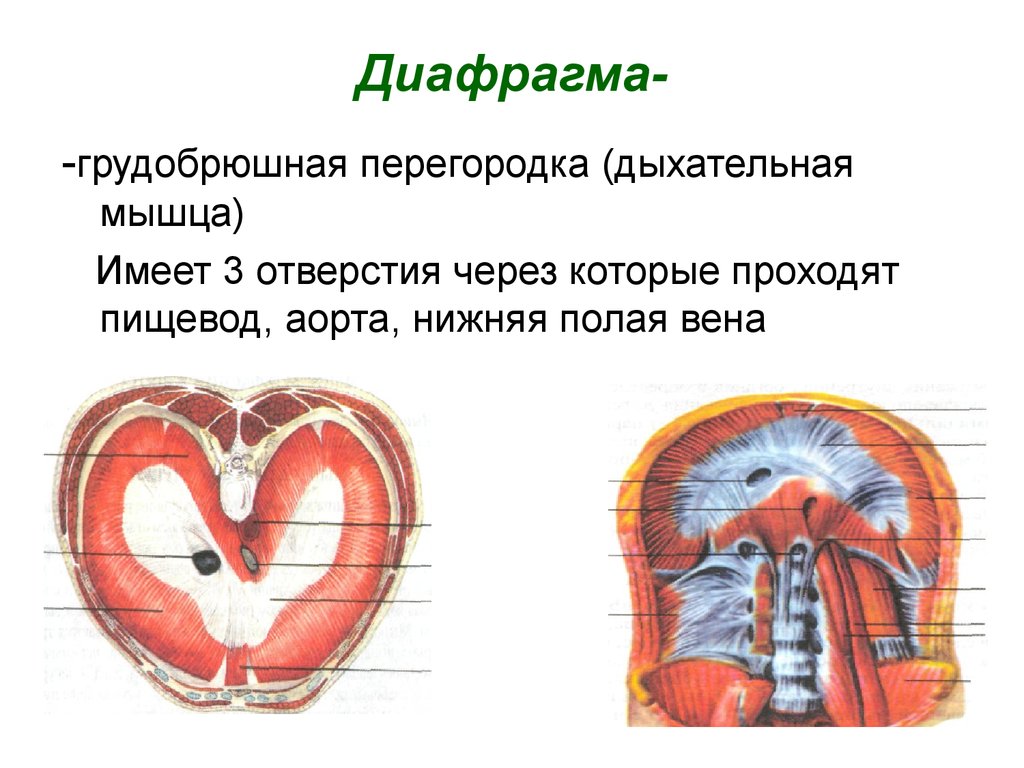 1990. Vol. 259. N 4. P. h2295–h2304.
1990. Vol. 259. N 4. P. h2295–h2304.
46. Muller-Delp J.M., Spier S.A., Ramsey M.W., Delp M.D. Aging impairs endothelium-dependent vasodilation in rat skeletal muscle arterioles // Am. J. Physiol. Heart Circ. Physiol. 2002. Vol. 283. N 4. P. h2662–h2672.
47. Aaker A., Laughlin M.H. Differential adenosine sensitivity of diaphragm and skeletal muscle arterioles // J. Appl. Physiol. 2002. Vol. 93. N 3. P. 848–856.
48. Гайнуллина Д.К., Кирюхина О.О., Тарасова О.С. Оксид азота в эндотелии сосудов: регуляция продукции и механизмы действия // Успехи физиол. наук. 2013. Т. 44. № 4. С. 88–102.
49. McAllister R.M. Endothelium-dependent vasodilation in different rat hindlimb skeletal muscles // J. Appl. Physiol. 2003. Vol. 94. N 5. P. 1777–1784.
50. Copp S.W., Holdsworth C.T., Ferguson S.K., Hirai D.M., Poole D.C., Musch T.I. Muscle fibre-type dependence of neuronal nitric oxide synthase-mediated vascular control in the rat during high speed treadmill running // J. Physiol. 2013. Vol. 591. N 11. P. 2885–2896.
2013. Vol. 591. N 11. P. 2885–2896.
51. Shipley R.D., Kim S.J., Muller-Delp J.M. Time course of flow-induced vasodilation in skeletal muscle: contributions of dilator and constrictor mechanisms // Am. J. Physiol. Heart Circ. Physiol. 2005. Vol. 288. N 4. P. h2499–h2507.
52. Александрова Н.П., Баранов В.М., Тихонов М.А., Колесников В.И., Котов А.Н., Кочанов В.С. Влияние антиортостатической гипокинезии на функциональное состояние диафрагмы у крыс // Рос. физиол. журн. им. И.М. Сеченова. 2005. Vol. 91. N 11. P. 1312–1319.
53. Neder J.A., Marillier M., Bernard A., Matthew J.D., Kathryn M.M., O’Donnell D.E. The integrative physiology of exercise training in patients with COPD // COPD: 2019. Vol. 16. N 2. P. 182–195.
54. Illi S.K. Held U., Frank I., Spengler C.M. Effect of respiratory muscle training on exercise performance in healthy individuals: A systematic review and metaanalysis // Sports Med. 2012. Vol. 42. N 8. P. 707–724.
Функции апертуры — документация Tas Building Simulator 9.
 5.4
5.4 Функции апертуры используются для управления открываемой пропорцией поверхности в Building Simulator на основе таких динамических факторов, как:
Существует ряд мнемоник функциональных строк, которые можно использовать для обозначения различных конфигураций этого диалогового окна.
При использовании планирования в сочетании с автоматическим управлением можно создавать и моделировать очень сложные системы. Значение из расписания диафрагмы (ноль или единица) умножается на значение открытия из функции автоматического управления. Это позволяет автоматически управлять диафрагмой и использовать ее только в определенное время суток.
Каждый режим можно рассматривать как набор «правил», например. закрытие окна выше определенной скорости ветра является правилом во всех режимах. Затем каждое правило можно рассматривать как функцию, производящую «сигнал», значение от нуля до единицы, указывающее, должно ли окно быть открытым («1») или закрытым («0»).
Например, правило ветра может быть представлено следующим графиком:
Правило температуры зоны может быть представлено следующим образом:
Правило отключения, такое как отключение внешней температуры, может быть представлено следующим образом:
Во время симуляции программа вычислит произведение всех своих правил, и результирующий сигнал будет управлять пропорцией открытия апертуры.
Zone Control
Эта функция используется для моделирования систем смешанного режима, в которых управление открытием осуществляется по температуре сухого термометра в одной зоне.
Если используется отсечка в смешанном режиме, отверстия закроются, когда температура зоны превысит пороговое значение. Обычно это делается для того, чтобы обеспечить охлаждение через внутренние условия.
Зона
Температура сухого термометра в этой зоне будет контролировать апертуру.
Нижний предел
Отверстие закрывается, когда температура зоны по сухому термометру ниже этого значения.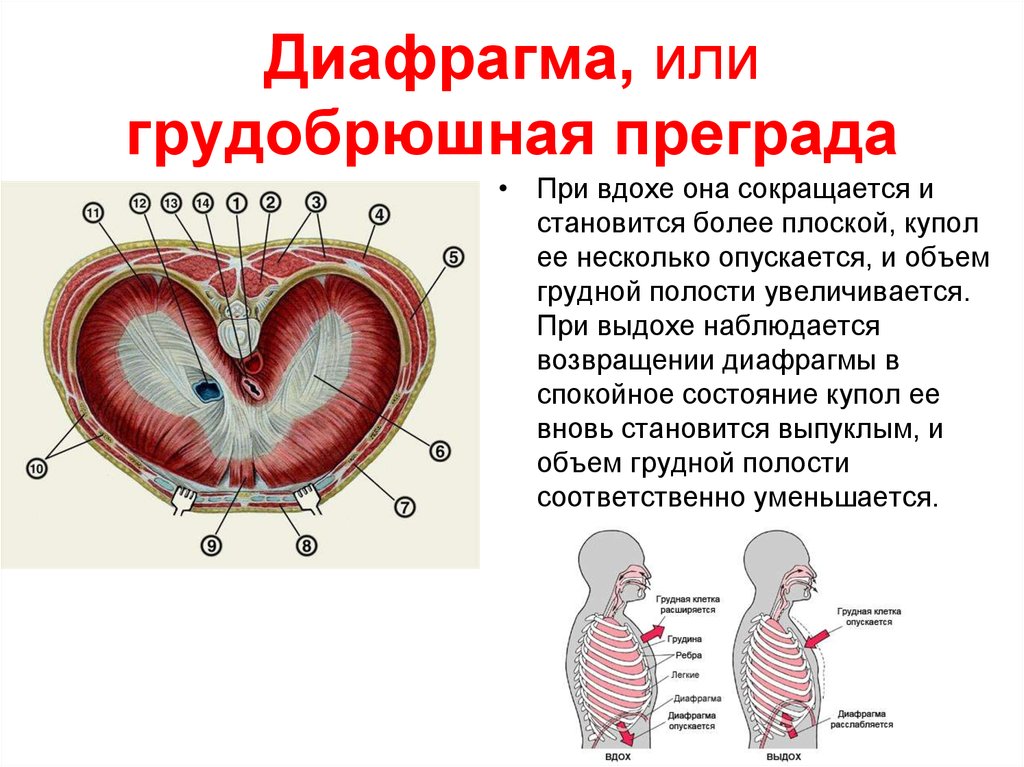
Верхний предел
Отверстие будет полностью открыто, когда температура зоны по сухому термометру превысит это значение.
Отсечка
Отверстие начнет закрываться, когда температура по сухому термометру в контролируемой зоне поднимется выше этого значения. Диафрагма полностью закрыта, когда температура на 1°C выше этого значения.
Верхняя скорость ветра
Проем начнет закрываться, когда скорость ветра превысит это значение. Он будет полностью закрыт, когда апертура \(0,5 м/с\) выше этого значения.
Пример
| Зона |
Восточный офис |
|---|---|
| Нижний предел |
22°C |
| Верхний предел |
24°C |
| Отсечка |
25°C |
| Скорость ветра на высотах |
5,0 \(м/с\) |
Когда температура по сухому термометру в зоне 5 превысит 22°C, диафрагма начнет открываться.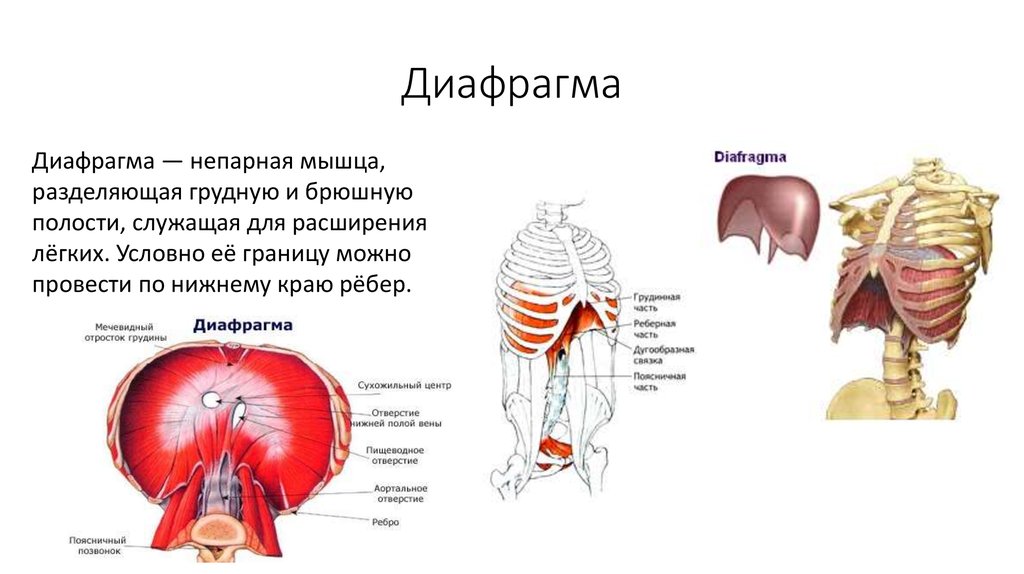 Апертура будет полностью открыта при 24°C и останется полностью открытой до 25°C, после чего она начнет закрываться. При 26°С и выше диафрагма будет закрыта.
Апертура будет полностью открыта при 24°C и останется полностью открытой до 25°C, после чего она начнет закрываться. При 26°С и выше диафрагма будет закрыта.
Отверстие также закроется, если в какой-либо момент внешняя температура превысит внутреннюю температуру. Отверстие начинает закрываться, когда две температуры равны, и полностью закрывается, когда наружная температура на один полный градус выше внутренней.
Скорость ветра также начнет закрывать проем при увеличении скорости выше 5 м/с и будет полностью закрыта при скорости 5,5 м/с.
Групповой контроль пиковой температуры
Эта функция используется для моделирования сгруппированных систем со смешанным режимом, в которых апертуры управляются по максимальной температуре по сухому термометру в группе зон.
Отверстия закрываются, когда максимальная температура группы превышает пороговое значение, поэтому можно ввести механическое охлаждение через внутренние условия.
Группа зон
Зона с самой высокой температурой по сухому термометру в этой группе будет управлять апертурой.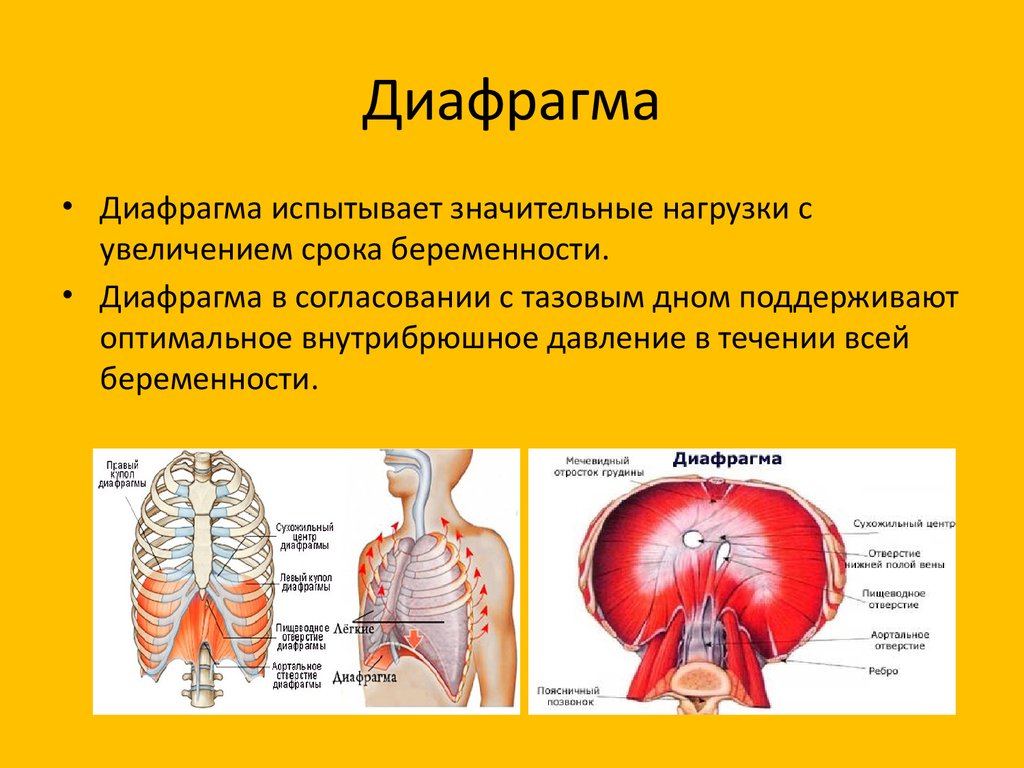
Нижний предел
Отверстие будет закрыто, если температура по сухому термометру в зоне контроля будет ниже этого значения.
Верхний предел
Отверстие будет полностью открыто, если температура по сухому термометру в зоне контроля превысит это значение.
Отключение
Отверстие начнет закрываться, когда зона с самой высокой температурой в группе зон управления превысит эту температуру. Диафрагма будет полностью закрыта при температуре на 1°C выше этого значения.
Верхняя скорость ветра
Проем начнет закрываться, когда скорость ветра превысит это значение, и полностью закроется, когда скорость ветра \(0,5 м/с\) превысит это значение.
Пример
| Группа зон |
Офисы |
|---|---|
| Нижний предел |
22°C |
| Верхний предел |
24°C |
| Отсечка |
25°C |
| Скорость ветра на высотах |
5,0 \(м/с\) |
Когда максимальная групповая температура в группе зон «Офисы» поднимется выше 22°C, проем начнет открываться. Апертура будет полностью открыта при 24°C и останется полностью открытой до 25°C, после чего она начнет закрываться. При 26°С и выше диафрагма будет закрыта.
Апертура будет полностью открыта при 24°C и останется полностью открытой до 25°C, после чего она начнет закрываться. При 26°С и выше диафрагма будет закрыта.
Отверстие также закроется, если в любой момент наружная температура превысит максимальную температуру группы. Отверстие начинает закрываться, когда две температуры равны, и полностью закрывается, когда наружная температура на один полный градус выше внутренней.
Скорость ветра также начнет закрывать проем, когда он превысит 5 м/с, и полностью закроется при скорости 5,5 м/с.
Управление зоной с переопределением зоны
Эта функция используется для моделирования системы, в которой управление открытием осуществляется по температуре сухого термометра в одной зоне.
Если температура по сухому термометру превышает пороговое значение, отверстия закрываются, чтобы можно было ввести механическое охлаждение за счет внутренних условий.
Кроме того, определена еще одна зона, которая действует как блокирующий элемент управления, поэтому, если температура по сухому термометру превышает пороговое значение, апертура закрывается.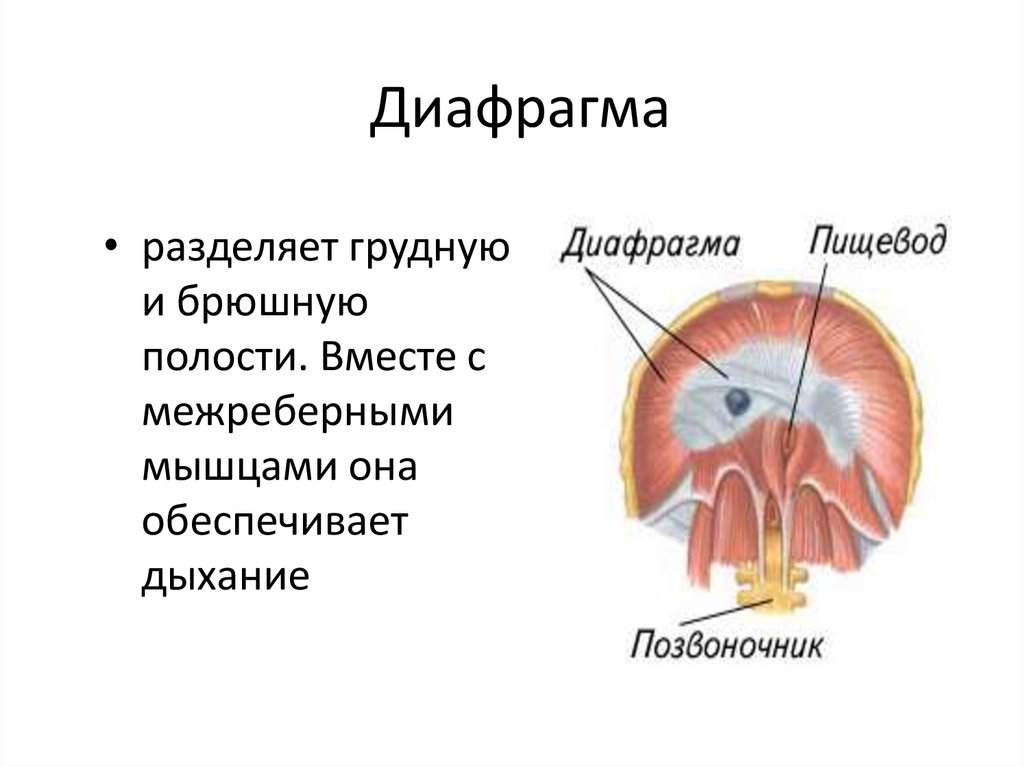
Зона
Температура сухого термометра в этой зоне будет контролировать апертуру.
Зона блокировки
Температура по сухому термометру в этой зоне используется в качестве дополнительного контроля отключения.
Нижний предел
Отверстие будет закрыто, если температура по сухому термометру в зоне контроля будет ниже этого значения.
Верхний предел
Отверстие будет полностью открыто, если температура по сухому термометру в зоне контроля превысит это значение.
Cut-off
Отверстие начнет закрываться, когда зона с самой высокой температурой в группе зон управления превысит эту температуру. Диафрагма будет полностью закрыта при температуре на 1°C выше этого значения.
Верхняя скорость ветра
Проем начнет закрываться, когда скорость ветра превысит это значение, и полностью закроется, когда скорость ветра \(0,5 м/с\) превысит это значение.
Пример
| Зона |
Восточный офис |
|---|---|
| Нижний предел |
22°C |
| Верхний предел |
24°C |
| Отсечка |
25°C |
| Скорость ветра на высотах |
5,0 \(м/с\) |
Когда температура сухого термометра в «Восточном офисе» поднималась выше 22°C, апертура начинала открываться. Апертура будет полностью открыта при 24°C и останется полностью открытой до 25°C, после чего она начнет закрываться. При 26°С и выше диафрагма будет закрыта.
Апертура будет полностью открыта при 24°C и останется полностью открытой до 25°C, после чего она начнет закрываться. При 26°С и выше диафрагма будет закрыта.
Отверстие также закроется, если в какой-либо момент внешняя температура превысит внутреннюю температуру. Отверстие начинает закрываться, когда две температуры равны, и полностью закрывается, когда наружная температура на один полный градус выше внутренней.
Скорость ветра также начнет закрывать проем при увеличении скорости выше 5 м/с и будет полностью закрыта при скорости 5,5 м/с.
Наконец, когда температура сухого термометра в «Западном офисе» поднимется выше 25°C, апертура начнет закрываться. При температуре «Западного офиса» выше 26°C проем закрывается.
Управление зонами с группой переопределения
Эта функция используется для моделирования системы, в которой проемы контролируются температурой по сухому термометру одной зоны.
Эта функция может использоваться для закрытия проемов, когда температура в зонах контроля превышает определенное пороговое значение, поэтому механическое охлаждение может быть введено через внутренние условия.
Кроме того, указана группа зон, которая действует как элемент управления переопределением. Если в какой-либо зоне в этой группе температура по сухому термометру превышает температуру отсечки, апертура закроется.
Зона
Температура сухого термометра в этой зоне будет контролировать апертуру.
Блокировка группы зон
Если какая-либо зона в этой группе имеет температуру выше температуры отключения, апертура закрывается.
Нижний предел
Отверстие закрывается, когда температура по сухому термометру в зоне контроля ниже этой температуры.
Верхний предел
Отверстие открывается, когда температура по сухому термометру в контролируемой зоне превышает это значение.
Отключение
Отверстие начинает закрываться, когда температура поднимается выше этого значения. Диафрагма полностью закрыта, когда температура по сухому термометру на 1°C выше этой температуры.
Верхняя скорость ветра
Проем начнет закрываться, когда проем превысит эту скорость ветра, и полностью закроется при \(0,5 м/с\) выше этого значения.
Пример
| Зона |
Восточный офис |
|---|---|
| Блокировка группы зон |
Офисы |
| Нижний предел |
22°C |
| Верхний предел |
24°C |
| Отсечка |
25°C |
| Скорость ветра на высотах |
5,0 \(м/с\) |
Когда температура сухого термометра в Восточном офисе поднималась выше 22°C, диафрагма начинала открываться.
Отверстие будет полностью открыто при 24°C и останется полностью открытым до 25°C, после чего оно начнет закрываться.
При температуре 26°C и выше отверстие закрывается.
Отверстие также закроется, если в какой-либо момент внешняя температура превысит внутреннюю температуру. Отверстие начинает закрываться, когда две температуры равны, и полностью закрывается, когда наружная температура на один полный градус выше внутренней.
Скорость ветра также начнет закрывать проем, когда он превысит 5 м/с, и полностью закроется при скорости 5,5 м/с.
Наконец, в группе зон «Офисы» будет произведен поиск зоны с самой высокой температурой, затем при повышении этой температуры выше 25°C проем начнет закрываться. Когда максимальная температура в этой группе зон превысит 26°C, диафрагма будет закрыта.
Комплексный смешанный режим с управлением охлаждением
Эта функция используется при моделировании сложных систем смешанного режима включения/выключения, в которых управление отверстиями осуществляется на основе температуры по сухому термометру одной зоны, а максимальная температура групп зон.
Отверстия закрываются, когда температура зоны или максимальная температура группы превышает пороговое значение, поэтому можно ввести механическое охлаждение с помощью внутренних условий.
Однако уставка для охлаждения установки может быть ниже диапазона управления для апертуры, в результате чего зоны группы зон полностью кондиционируются.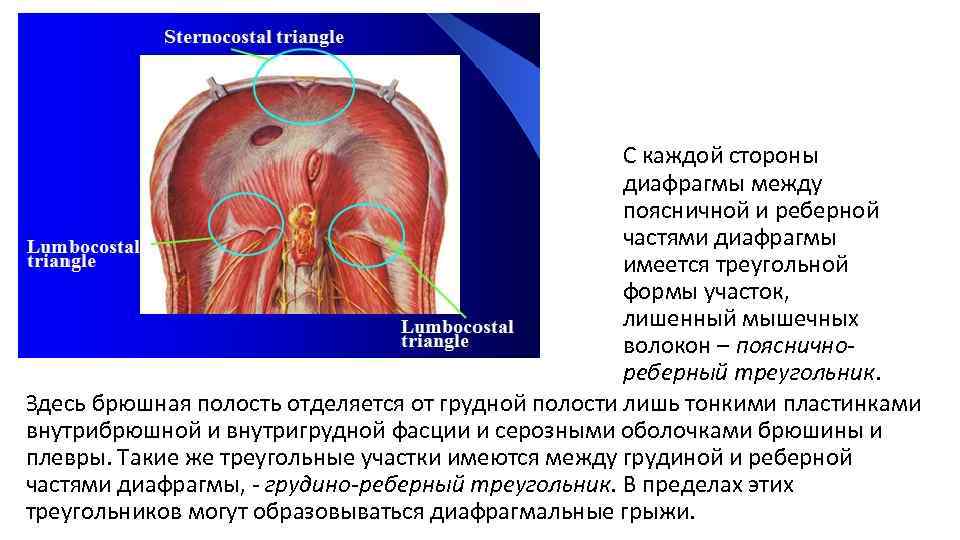 Полосы управления перекрываются, позволяя только одному элементу управления быть активным одновременно, это достигается следующим образом.
Полосы управления перекрываются, позволяя только одному элементу управления быть активным одновременно, это достигается следующим образом.
В начале каждого дня каждый активный тип апертуры в этом режиме имеет каждую зону своей группы зон, помечаемую как «завод неактивен». Это гарантирует, что даже несмотря на то, что заданные значения во внутренних условиях указывают, что установка должна быть включена, это фактически игнорируется. Во время моделирования дня, если в какой-либо час температура в зоне превысит пороговую температуру, тип апертуры будет помечен как неактивный, а установка снова будет включена для всех зон в группе контролирующих зон. Это состояние будет продолжаться до начала следующего дня, когда все флаги будут сброшены, как описано ранее. Для этого режима требуются следующие параметры.
Зона
Температура сухого термометра в этой зоне будет контролировать апертуру.
Блокировка группы зон
Если какая-либо зона в этой группе имеет температуру выше температуры отключения, апертура закрывается.
Нижний предел
Отверстие закрывается, когда температура по сухому термометру в зоне контроля ниже этой температуры.
Верхний предел
Отверстие открывается, когда температура по сухому термометру в контролируемой зоне превышает это значение.
Отключение
Отверстие начинает закрываться, когда температура поднимается выше этого значения. Диафрагма полностью закрыта, когда температура по сухому термометру на 1°C выше этой температуры. Затем кондиционер активируется для всех зон в группе управления.
Верхняя скорость ветра
Проем начнет закрываться, когда проем превысит эту скорость ветра, и полностью закроется при \(0,5 м/с\) выше этого значения.
Пример
| Зона |
Восточный офис |
|---|---|
| Блокировка группы зон |
Офисы |
| Нижний предел |
22°C |
| Верхний предел |
24°C |
| Отсечка |
25°C |
| Скорость ветра на высотах |
5,0 \(м/с\) |
Когда температура по сухому термометру в восточной части офиса поднималась выше 22°C, апертура начинала открываться.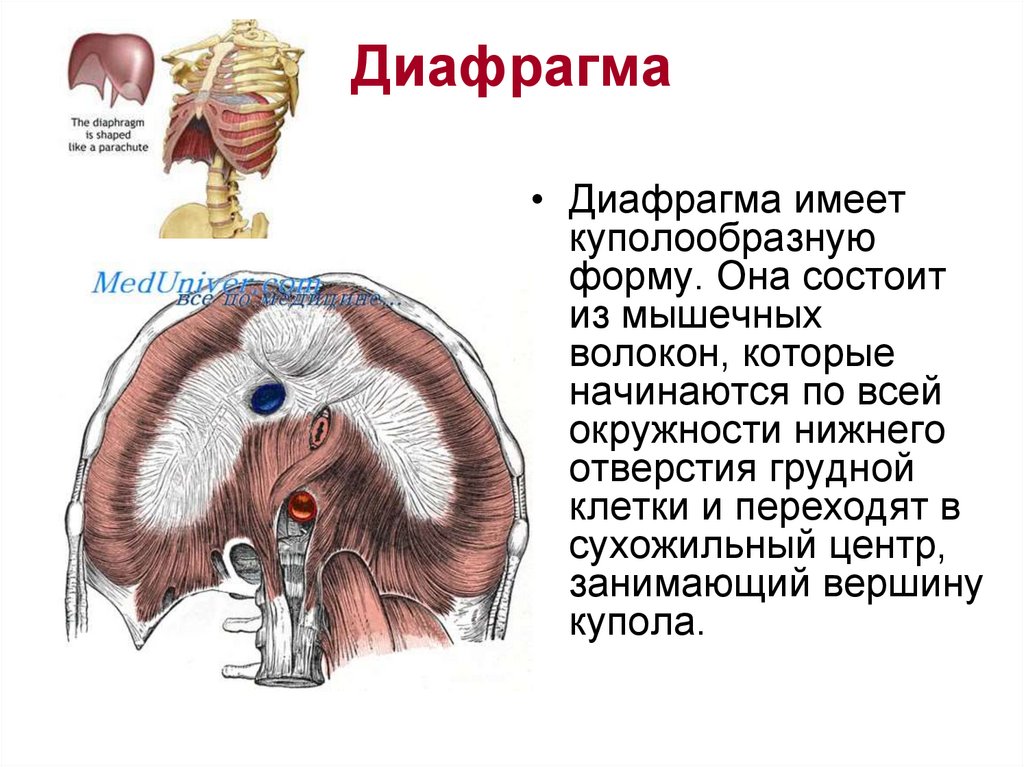
Отверстие также закроется, если в какой-либо момент внешняя температура превысит внутреннюю температуру. Отверстие начинает закрываться, когда две температуры равны, и полностью закрывается, когда наружная температура на один полный градус выше внутренней.
Скорость ветра также начнет закрывать проем, когда он превысит 5 м/с, и полностью закроется при скорости 5,5 м/с.
Наконец, группа зон «офисы» будет искать зону с самой высокой температурой. Когда самая высокая температура поднимется выше 25°C, апертура закроется, и все зоны группы зон «офисы#» будут переведены в режим полного переменного тока.
Часть O
Эта функция является копией функций диафрагмы Zone Control , за исключением того, что если температура по сухому термометру в контролируемой зоне превышает 23°C в 23:00, апертура остается полностью открытой до 8:00 следующего дня.
Данная функция введена для моделирования в соответствии с Утвержденным документом О.
Предупреждение
Расписания не должны использоваться с этой функцией диафрагмы.
Эта функция имеет внутреннюю мнемонику «zdwno».
Апертурная фотометрия — документация 1.0.0
Доступны четыре функции диафрагмы:
| Функция | Суммирует данные в… |
|---|---|
sep.sum_circle |
круг(и) |
sep.sum_circann |
круглое кольцо/кольцо |
sep.sum_ellipse |
эллипс(ы) |
sep.sum_ellipann |
эллиптическое кольцо/кольца |
Следующие примеры демонстрируют варианты для круглого отверстия фотометрия. Аналогично ведут себя и другие функции.
# суммарный поток в кругах радиусом=3.0 поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.0) # x, y и r могут быть массивами и подчиняться правилам вещания numpy. # Здесь r представляет собой массив, а не одно число: поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.0 * np.ones(len(objs))) # использовать другую выборку субпикселей (по умолчанию 5; 0 означает "точная") поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.0, субпиксель = 0)
Расчет ошибки
В показанных выше режимах по умолчанию неопределенность fluxerr равна
не рассчитывается, и значения 0 просто возвращаются. Неопределенность может быть
гибко и эффективно рассчитываются в зависимости от характеристик
ваших данных. Наличие ключевого слова err или var указывает на
шум на пиксель, в то время как наличие ключевого слова усиления указывает
что следует включить неопределенность Пуассона в общую сумму. Немного
иллюстративных примеров:
Немного
иллюстративных примеров:
# Укажите попиксельную "фоновую" ошибку и усиление. Это подходит
# когда данные были вычтены из фона.
поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.0,
ошибка=bkg.globalrms, усиление=1.0)
# Вместо ошибки может быть передана дисперсия с идентичными результатами.
поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.0,
var=bkg.globalrms**2, усиление=1.0)
# Ошибка или дисперсия могут быть массивами, указывая на то, что фоновая ошибка
# является переменной.
bkgrms = bkg.rms() # массив той же формы, что и данные
поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.0,
ошибка=bkgrms, усиление=1.0)
# Если ваш массив неопределенностей уже включает шум Пуассона от объекта,
# оставьте усиление равным None (по умолчанию):
поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.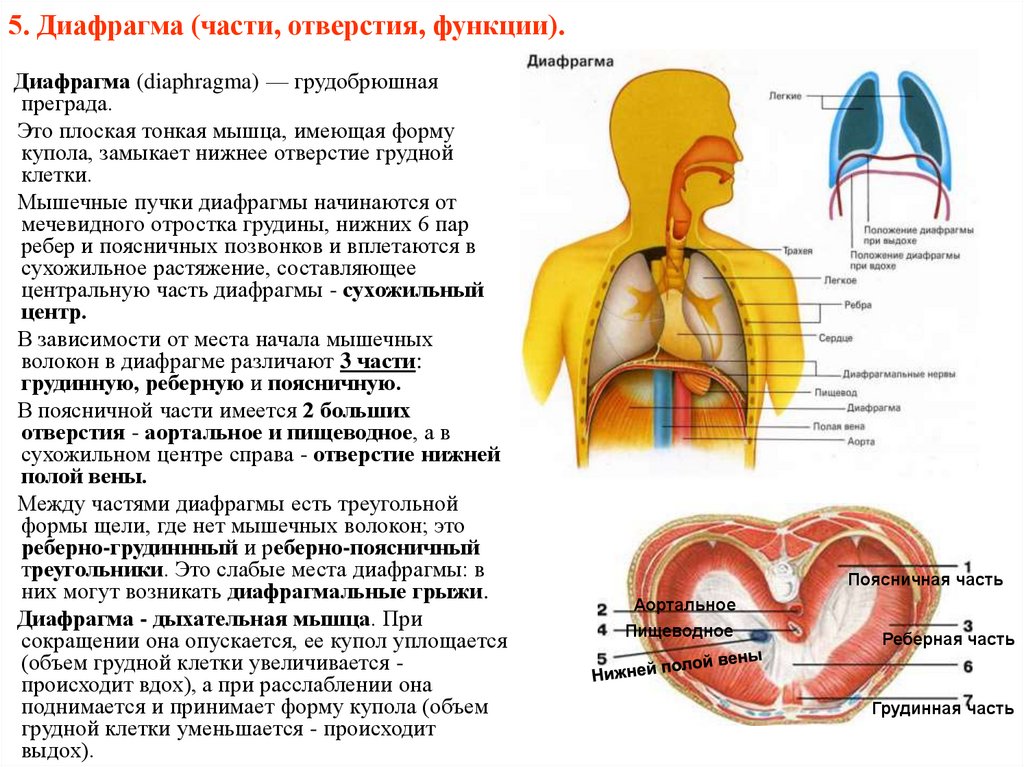
0,
err=массив_ошибок)
# Если ваши данные представляют собой необработанные подсчеты (они не вычитаются из фона),
# установить только усиление, чтобы получить ошибку Пуассона:
поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.0,
усиление=1.0)
92 + F/g\] где сумма по пикселям в апертуре, \(\sigma_i\)
шума в каждом пикселе, \(F\) - сумма в апертуре и
\(g\) — выигрыш. Последний член не добавляется, если усиление равно
Нет .
Маскирование
Применение маски (той же формы, что и данные). Пиксели, где маска имеет значение True,
«скорректировано» до среднего значения в пределах диафрагмы.
поток, fluxerr, флаг = sep.sum_circle(данные, objs['x'], objs['y'], 3.0,
маска = маска)
Вычитание локального фона
Функции sum_circle и sum_ellipse имеют опции
для выполнения локального вычитания фона.
Функции диафрагмы: Анатомия : Диафрагма. 