21 факт о структуре и характеристиках Льюиса K2s —
Сульфид калия — редко встречающееся неорганическое соединение. Давайте обсудим некоторые факты о сульфиде калия со всеми его подробностями.
Сульфид калия (k2s) представляет собой бесцветное твердое вещество желтого цвета при загрязнении любыми примесями. Молярная масса сульфида калия составляет 110.262 г/моль. Его запах похож на запах тухлых яиц и похож на сероводород.2S. Температура кипения и плавления сульфида калия составляет 912.0 С, 8400С соответственно.
Он гигроскопичен. Это может привести к серьезным опасностям, таким как ожоги кожи, опасность возгорания и экологические проблемы. Сульфид калия получают нагреванием сульфата калия с коксом или взаимодействием калия с серой в присутствии аммиака. Давайте рассмотрим некоторые детали сульфида калия в следующих разделах.
Как рисовать К2Структура Льюиса?
Компания Структура Льюиса молекулы или соединения, чтобы понять, как образовалась связь. Давайте поймем, как изобразить Структура Льюиса сернистого калия.
Давайте поймем, как изобразить Структура Льюиса сернистого калия.
Прежде всего нам нужно получить представление о задействованных здесь валентных электронах. Валентные электроны, присутствующие в калии и сере, составляют 1 соответственно.
Признайте его формирование связиМы знаем, что калий, будучи металлом, всегда отдает свои электроны, а сера, будучи неметаллом, имеет тенденцию принимать эти электроны в себя.
Назначьте его структуру ЛьюисаТак что здесь вместо взаимного обмена только один атом делится своими электронами, а другой принимает это. Следовательно, здесь образуется ионная связь. Два атома калия делят один электрон на один электрон серы, образуя ионную связь.
Структура Льюиса K2S
K2Правило октета структуры ЛьюисаВ соответствии с правилом октета в валентной оболочке атома должно быть восемь электронов, если он образует устойчивую связь. Давайте обсудим, подчиняется ли k2s правилу октетов или нет.
Давайте обсудим, подчиняется ли k2s правилу октетов или нет.
K2Структура Льюиса подчиняется правилу октетов. Два атома калия отдают один электрон сере, чтобы удовлетворить свой октет, в то время как сера с шестью валентными электронами принимает эти два электрона от двух атомов калия, чтобы выполнить свой октет. Итак, здесь оба атома подчиняются правилу октетов.
K2Структурный резонанс Льюиса
Резонанс — это делокализация электронов, участвующих в молекуле. Посмотрим, подвергается ли сульфид калия резонансу.
K2S Структура Льюиса не подвергается резонансу. Потому что это ионное соединение, которое образуется в результате притяжения между положительно заряженным катионом и отрицательно заряженным анионом.
K2S Форма структуры Льюиса
Форму молекулы можно определить с помощью теории отталкивания пар электронов валентной оболочки.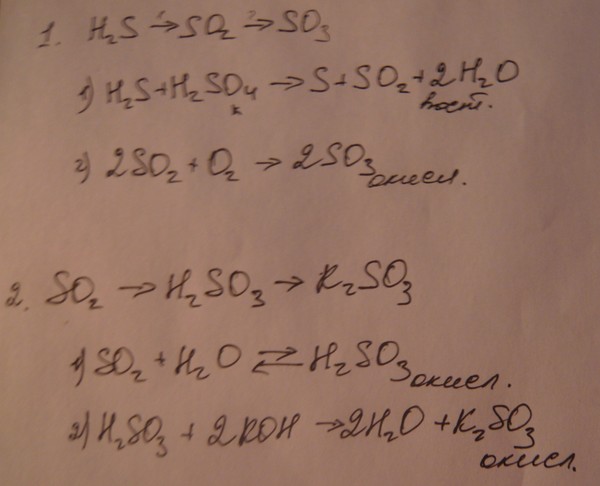 Определим строение сульфида калия.
Определим строение сульфида калия.
Форма K2Структура S Льюиса представляет собой кристаллоподобную структуру, похожую на структуру антифлюорита. Электронная геометрия тетраэдрическая. Форму любой молекулы выясняют в соответствии с теорией ВСЕПР.
K2S Угол связи структуры Льюиса
Валентный угол можно определить как угол между атомами, присутствующими в молекуле. Давайте посмотрим на угол сульфида калия.
Сульфид калия представляет собой соединение с валентным углом 109.50. Поскольку он имеет тетраэдрическую электронную геометрию, он имеет этот валентный угол.
K2S Структура Льюиса Формальный зарядФормальный заряд любого соединения можно найти с помощью простой формулы, которая приведена ниже. Выясним формальный заряд сульфида калия.
Формальный заряд сульфида калия равен нулю, и он стабилен.
- Формальный заряд = валентные электроны – несвязывающие электроны – количество связей
- Формальный заряд калия = 1-0-1 = 0
- Формальный заряд серы = 6-4-2 = 0
Электроны, присутствующие во внешней оболочке любого атома, называются его валентными электронами. Посмотрим, сколько валентных электронов имеет сульфид калия.
K2S Структура Льюиса содержит восемь валентных электронов.Внешняя электронная конфигурация калия 4s¹, а серы 3s² 3p⁴. Таким образом, у них есть один и шесть электронов на внешней оболочке соответственно. Всего в его валентной оболочке восемь электронов.
Электроны, не участвовавшие в связывании, называются несвязывающими электронами или неподеленными парами. Давайте посмотрим, есть ли в сульфиде калия какая-нибудь неподеленная пара. В сульфиде калия неподеленные пары наблюдаются только в сере. Сера с шестью электронами получает два электрона от двух атомов калия, чтобы сформировать их связь. Из шести электронов в сере две неподеленные пары или четыре несвязывающих электрона. Гибридизация — это процесс, полностью связанный с ковалентными соединениями. Рассмотрим гибридизацию в сернистом калии. Ионные соединения нельзя объяснить с точки зрения гибридизации. Таким образом, в K нет гибридизации.2S. Здесь нельзя использовать гибридизацию, потому что ионные соединения, образованные чередованием положительных и отрицательных зарядов, образуют плотно упакованную кристаллическую структуру. Кристаллическая структура сульфида калия антифлуритная, где мелкие ионы калия занимают тетраэдрические позиции, крупные сульфидные ионы — в восьми координатных позициях. Способность вещества снабжать H+ ионов — кислотная сила и способность отдавать ОН– ионы это основная сила. Сульфид калия является основным веществом. Давайте знать, почему сульфид калия проявляет основные природа. Кислотность или щелочность любого вещества определяется его значением pH. Установлено, что pH сульфида калия больше семи. Таким образом, это является основным в природе. Растворимость вещества – это его способность растворяться в другой жидкости. Посмотрим на растворимость сульфида калия в различных растворах. Сульфид калия полностью растворим в воде. Он растворяется в воде с образованием гидросульфида калия KSH и гидроксида калия KOH. Вместо этого сульфид калия растворим в этаноле, глицерине и нерастворим в эфире. Попробуем понять растворимость k2s в воде. K2S растворяется в воде. Сульфид калия представляет собой полярную молекулу, поэтому он может легко взаимодействовать с водой. Ковалентные соединения образуются путем взаимного обмена электронами между атомами. Давайте поймем, что сульфид калия имеет ковалентный или ионный характер. Сульфид калия является ионным соединением. Калий отдает один электрон сере, образуя сульфид калия. Дайте нам знать больше об ионном характере сульфида калия. K2S имеет ионную природу. Когда металлический калий отдает электрон, он становится положительно заряженным, а сера принимает его и становится отрицательно заряженным. Здесь один атом отдает, а другой принимает электрон. Оба противоположно заряженных атома притягиваются, образуя здесь ионную связь. Электролит – это вещество, которое диссоциирует в воде с образованием заряженных ионов. Сульфид калия — электролит, проводящий электричество. Дайте нам знать больше об электролитических свойствах k2s. K2S является электролитом. Это связано с тем, что сульфид калия, будучи полярной молекулой, при растворении в воде диссоциирует на ионы и проводит электричество. Так Полярность — явление, возникающее из-за изменения дипольного момента атомов в молекуле. Давайте посмотрим, что сульфид калия имеет полярную или неполярную природу в приведенном ниже описании. k2s является полярной молекулой из-за разницы в значениях дипольного момента калия и серы. Калий представляет собой щелочной металл в то время как сера является неметаллом. Проверим, по каким причинам kes является полярным. Когда два противоположно заряженных атома находятся на некотором расстоянии друг от друга, возникает фактор, называемый дипольным моментом, и такие соединения будут полярными. Если нет, то они будут неполярными. В некоторых случаях наличие двух противоположных зарядов может создать полярное соединение. Симметричное расположение атомов может компенсировать друг другу дипольный момент и они будут иметь неполярный характер. Таким образом, не только заряды, расположение атомов также определяет, является ли оно полярным или нет. Водный означает, является ли вещество жидким, как природа, или растворенным в воде. Давайте обсудим К.2S является водным или неводным. Сульфид калия представляет собой бесцветное твердое вещество, которое редко встречается. Соль – это вещество, которое образуется в результате реакции между кислотой и основанием. Сульфид калия представляет собой соль, состоящую из катиона калия и аниона сульфида. Соль представляет собой нейтральное вещество с положительно и отрицательно заряженными ионами. Основание — это вещество, которое отдает OH– ионов при растворении в воде. Обсудим силу основности в K2S. Установлено, что сульфид калия является основным по своей природе. Давайте изучим сильную основность k2s. k2s образует гидроксид калия сильное основание когда он растворяется в воде. Поэтому при растворении в воде сульфид калия является сильным основанием. Ковалентные связи возникают из-за общего обмена электронами между атомами. Сульфид калия представляет собой ионное соединение, а не ковалентное соединение. Потому что он образуется притяжением двух противоположных зарядов. Давайте посмотрим, почему k2s не является ковалентным. k2s образуется за счет притяжения между положительным ионом калия и отрицательным сульфид-ионом. Таким образом, здесь нет возможности образования ковалентной связи. Газ – это форма вещества, не имеющая определенной формы и объема. Давайте посмотрим на природу К.2S то есть твердое ли оно, жидкое или газообразное. Сульфид калия представляет собой твердое, а не газообразное вещество. Газ – это фаза, в которой нет формы и объема. Но здесь k2s имеет определенную форму. Диполь-дипольное взаимодействие — это межмолекулярная сила, существующая между определенными молекулами. Диполь Дипольное взаимодействие наблюдается в сульфиде калия. В k2s существует возможность взаимодействия между положительным калием одного K2S с отрицательной серой других K2S. Таким образом, между молекулами сульфида калия может существовать диполь-дипольное взаимодействие. Поскольку существует притяжение между диполем одной молекулы к другой К2S испытывают диполь-дипольное притяжение. Заключение Сульфид калия — неорганическое соединение, которое используется в пиротехнике, аналитической химии, медицине. Узнайте больше о Структура и характеристики гелия Структура Льюиса h3SO4 Структура и характеристики Льюиса XeO2
K2S Структура Льюиса Одиночные пары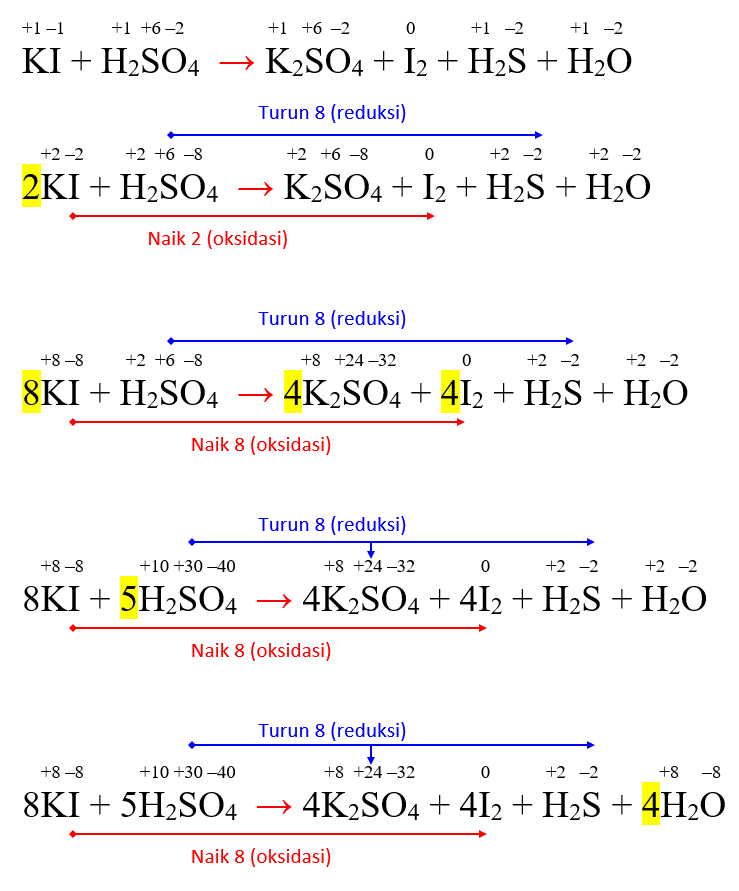
K2Гибридизация структуры S Льюиса Посмотрим, кислый сульфид калия или нет.
Посмотрим, кислый сульфид калия или нет.Почему и как k2s является базовым?
К2S Растворим в воде?Почему и как k2s растворяется в воде?
 Потому что вода тоже полярная молекула. Оба соединения, будучи полярными по своей природе, могут очень легко взаимодействовать, поэтому они растворяются друг в друге.
Потому что вода тоже полярная молекула. Оба соединения, будучи полярными по своей природе, могут очень легко взаимодействовать, поэтому они растворяются друг в друге.Почему и как k2s является ионным?
 Сообщите нам, является ли сульфид калия электролитом.
Сообщите нам, является ли сульфид калия электролитом.Почему и как k2s является электролитом?
К2S Полярный или неполярный?Почему и как k2s является полярным?

 Сообщите нам К2S является солью или не солью.
Сообщите нам К2S является солью или не солью.Почему и как k2s является сильной базой?
 Узнаем, является ли К.2S является ковалентным или нет.
Узнаем, является ли К.2S является ковалентным или нет.Почему и как k2s не является ковалентным?
 Посмотрим, существует ли диполь-дипольное взаимодействие в сульфиде калия.
Посмотрим, существует ли диполь-дипольное взаимодействие в сульфиде калия.
Структура Льюиса HNO2
What, How to Balance & FAQs —
В реакции HCl+ K 2 S соляная кислота является сильной кислотой, а сульфид калия является основанием. Рассмотрим некоторые факты этой реакции.
Рассмотрим некоторые факты этой реакции.
Соляная кислота существует в жидком и твердом состояниях. HCl получают при контакте хлористого водорода с водой. Этот хлористый водород вызывает коррозию и может использоваться при переработке и производстве различных продуктов. K 2 S легко вступает в реакцию с водой. Он используется в качестве промежуточного продукта в производстве блесток .
мы обсудим некоторые характеристики этой реакции соляной кислоты и сульфида калия, такие как ее буферный раствор, энтальпия, энтропия, молекулярные силы и тип продуктов, образующихся во время реакции в этой реакции.
Что является продуктом HCl и K
2 S?Реакция HCl+ K 2 S дает хлорид калия и газообразный сероводород.
К 2 S + 2HCl → 2KCl + H 2 S
Какой тип реакции HCl + K
2 S Реакция соляной кислоты и сульфида калия является кислотно-основной реакцией.
Как сбалансировать HCl + K
2 S Реакцию HCl+ K 2 S можно сбалансировать, выполнив следующие шаги: Это первый шаг. Здесь атомами, присутствующими в этой реакции, являются калий, сера, водород и хлор. 5 атомов присутствуют как на стороне реагентов, так и на стороне продуктов, из которых атом H равен 1 и 2 на стороне реагента и продукта соответственно, тогда как K равен 2 и 1 на стороне реагента и продукта соответственно. K 2 S + HCl → KCl + H 2 S 4 90 S0030 уравновесить, расположив одинаковое количество атомов. Умножив 2 на HCl и 2 на H 2 S принята наша первая попытка. K 2 S + 2HCl → KCl + 2 H 2 S На этом этапе поместите KCl 2 в качестве коэффициента сбалансированное уравнение . K 2 S + 2HCl → 2KCl + H 2 S Наконец, умножение HCl на 2 и KCl на 2 делает реакцию сбалансированной. Сбалансированное химическое уравнение для вышеуказанной реакции: K 2 S + 2HCl → 2KCl + H 2 S HCl + K 2 S Титруя находится под сильной кислотой. В этой реакции мы стремимся рассчитать количество хлорида калия, образовавшегося в ходе реакции. Бюретка, пипетка, коническая колба, круглодонная колба, подставка для бюретки, промывочная бутыль. При титровании сильной кислоты против слабого основания, как правило, мы используем фенолфталеин в качестве индикатора; его конец бесцветный. Бюретка заполнена стандартным раствором соляной кислоты; и коническую колбу с основным раствором. Суммарное ионное уравнение реакции соляной кислоты и сульфида калия имеет вид; Сбалансируйте химическое уравнение, для которого необходимо найти результирующее ионное уравнение. Здесь атомы хлора не сбалансированы как со стороны реагентов, так и со стороны продуктов. Таким образом, мы должны умножить коэффициенты HCl и KCl на 2 моля, чтобы сбалансировать уравнение. Затем окончательное химическое уравнение ; K 2 S + 2HCl → 2KCl + H 2 S Разделить сильные электролиты на ионы на реагенты и продукты. 2K + + S 2 — + 2H + + 2CL — → 2K + + 2CL — + H + + 2CL — + H + .0005 Отменить ион зрителя с обеих сторон. Левое химическое уравнение можно назвать результирующим ионным уравнением этой реакции. Суммарное ионное уравнение реакции сульфида калия и соляной кислоты выглядит следующим образом; S 2 – + 2H + → H 2 S HCl and Cl – are the conjugate acid пар оснований в этой реакции HCl+k 2 S.HCl – сильная кислота, а ее сопряженное основание – Cl – . Сопряженные кислотно-основные пары Энтальпия реакции HCl+ K 2 S составляет -364,5 кДж. Его можно рассчитать, исключив суммы энтальпий продуктов из суммы энтальпий реагентов- (-471,5-167,16) -(-436,75-296,83) =-364,5 кДж. Энергетический профиль энтальпии Реакция между HCl+ K 2 S не может образовывать буферный раствор. Поскольку сильнокислотное сопряженное основание соляной кислоты Cl – (анион хлорида калия) слабый (соль). Реакция между HCl+ K 2 S является полной реакцией, потому что продукт хлорид калия может быть растворим в воде, поэтому он не вступает в дальнейшую реакцию. Реакция HCl+ K 2 S экзотермическая. При взаимодействии соляной кислоты с сульфидом калия выделяется некоторое количество тепла в виде энергии, и этой энергии достаточно для завершения реакции. Энергетический профиль экзотермической реакции Реакция между HCl+ K 2 S не является окислительно-восстановительной реакцией, поскольку не происходит переноса электронов. Реакция между HCl+ K 2 S не является реакцией осаждения, т.к. не образуется дополнительный нерастворимый продукт. Реакция между HCl+ K 2 S необратима, так как обратная реакция требует большого количества энергии, что невозможно в случае реакции между соляной кислотой и сульфид калия. Реакция HCl+K 2 S является двойной реакцией замещения, поскольку оба реагента смещаются со своего места и реагируют с другим реагентом. Реакция двойного замещения Здесь число атомов K равно 3 на стороне реагента и продукта соответственно, тогда как O равно 4 и 3; и H равно 1 и 2 на стороне реагента и продукта соответственно. Таким образом, реакция не уравновешена . KMnO 4 + K 2 S + HCl = MnCl 2 + SO 2 + KCl + H 2 O Реакция между KMnO 4 + K 2 S + HCl = MnCl 2 + SO 2 + KCl + H 2 O получают одинаковое количество сбалансированных атомов путем расположения. KMNO 4 + K 2 S + 4HCl = 2MNCL 2 + SO 2 + KCl + 2H 2 O Стадия 2. Установление сходства между числом молекул в реагентах и продуктах
Шаг 3: Поместите необходимое число в качестве коэффициента перед молекулой
Шаг 4: Написание сбалансированного уравнения
HCl + K
2 S Титрование Прибор
Индикатор
Процедура
 Индикатор также добавлен. Процесс продолжают до тех пор, пока окраска раствора не исчезнет. Эта точка изменения цвета является эквивалентной точкой. Тогда объем KCl находится по формуле V 1 S 1 =V 2 S 2 .
Индикатор также добавлен. Процесс продолжают до тех пор, пока окраска раствора не исчезнет. Эта точка изменения цвета является эквивалентной точкой. Тогда объем KCl находится по формуле V 1 S 1 =V 2 S 2 . HCl + K
2 S Суммарное ионное уравнение
Этап 1
Этап 2  Здесь сероводород не может быть сильным электролитом.
Здесь сероводород не может быть сильным электролитом. Шаг 3
HCl + K
2 S conjugate pairs HCl и K
2 S Межмолекулярные силы

HCl + K
2 S Энтальпия реакции Is HCl + K
2 S буферный раствор Is HCl + K
2 S полная реакция 
Is HCl + K
2 S экзотермическая или эндотермическая реакция Is HCl + K
2 S окислительно-восстановительная реакция Is HCl + K
2 S реакция осаждения Is HCl + K
2 S обратимая или необратимая реакция 
Is HCl + K
2 S реакция замещения Как уравновесить KMnO4 + K
2 S + HCl = MnCl 2 + SO 2 + KCl + H 2 O 2 900 следующие шаги: Этап 1: Определение количества атомов как на стороне реагентов, так и на стороне продуктов
 Умножая 4 на HCl, 2 на MnCl 2 и 2 с H 2 O наша первая попытка принята.
Умножая 4 на HCl, 2 на MnCl 2 и 2 с H 2 O наша первая попытка принята. Шаг 3: Установка требуемого числа в качестве коэффициента перед молекулой
.
На этом шаге, подставив 2 в качестве коэффициента HCl и 2 в качестве коэффициента KCl и 2 в качестве коэффициента H 2 O мы получим несбалансированное уравнение .
Kmno 4 + K 2 S + 2HCl = MNCL 2 + SO 2 +2 KCl + 2H 2 O
Шаг 4: Написание сбалансированного уравнения
на последнем Multyling 6 с KMnO 4 , 5 с K 2 S, 28 с HCl,6 с MnCl 2 ,5 с SO 2 , 16 с KCl, 14 с H 2 O . Следовательно, сбалансированное химическое уравнение для приведенной выше реакции равно ;
6KMNO4 + 5K 2 S + 28HCl = 6MNCL 2 + 5SO 2 + 16KCL + 14H 2 O
Заключение
. Формированный продукт. производство мыла. Он действует как ароматизатор, регулятор pH.
Формированный продукт. производство мыла. Он действует как ароматизатор, регулятор pH.
Подробнее о HCl:
HCl + ZnCO3
2K + S = K2S
| Поиск |
калий + сера = сульфид калия | Температура: 100 — 200
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Oxidation-reduction reaction
| 2K | + | S | → | png» substance-weight=»110.2616″> K 2 S | ||||||
| potassium | sulfur | potassium sulfide | ||||||||
| (rắn) | (rắn) | (rắn) | ||||||||
| (trắng bạc) | (vàng chanh) | |||||||||
| 2 | 1 | 1 | Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | ||||||||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении 2K + S → K
2 SВ каких условиях происходит реакция K (калий) с S (сера) ?
Температура: 100–200°C
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.
