Бесплатные курсы ФЦПРО для учителей
Бесплатные курсы ФЦПРО для учителейБесплатные курсы ФЦПРО для учителейКурсы в рамках мероприятий ГП «Развитие образования»
Ротобыльский К.А., Граб И.С., Мерзлякова Е.В., Крутиков М.А.
Ротобыльская Л.А., Крутиков М.А., Ласточкин А.В., Ротобыльский К.А.
Курсы в рамках проекта «Кадры для цифровой экономики»
Цифровой дизайн
Программа курса реализуется бесплатно, рамках государственной программы «Кадры для цифровой экономики» в дистанционном режиме
72 часа / Одна неделя обучения
ПРЕДВАРИТЕЛЬНАЯ ЗАПИСЬ
Граб И.С., Мерзлякова Е.В., Ротобыльский К.А., Ползикова Л.В.
Курсы Единого федерального портала цифровой образовательной среды ДПО
Ротобыльский К.А.
Крутиков М.А.
Драганова О.А.
Аксенова И.В.,зав.каф
Углова Н. В.,зав.каф
В.,зав.каф
Ротобыльская Л.А.,проректор
Про обучение на курсах
О курсах
Курсы предназначены для повышения квалификации педагогов общеобразовательных организаций в рамках реализации мероприятия «Модернизация технологий и содержания обучения в соответствии с новым федеральным государственным образовательным стандартом посредством разработки концепций модернизации конкретных областей, поддержки региональных программ развития образования и поддержки сетевых методических объединений» государственной программы «Развитие образования». Содержание программ курсов разработано на основе Федеральных государственных образовательных стандартов основного общего образования (ФГОС ООО) и требований профессионального стандарта «Педагог» с учетом диагностических исследований, проводимых в Липецкой области, и посвящено разработке и реализации межпредметных образовательных технологий.
Об удостоверениях
После прохождения итогового тестирования на одном из 5 курсов Вы получаете удостоверение установленного образца в электронном виде бесплатно. Если обучение проходит команда педагогов (более 15 человек из одной образовательной организации) Вы получаете дополнительно к электронным версиям их бумажные копии, высылаемые бесплатно почтой России на образовательную организацию.
Если обучение проходит команда педагогов (более 15 человек из одной образовательной организации) Вы получаете дополнительно к электронным версиям их бумажные копии, высылаемые бесплатно почтой России на образовательную организацию.
Как стать нашим партнером
Приглашаем на курсы повышения квалификации руководящих работников общеобразовательных организаций (директоров и заместителей), представителей муниципальных органов управления образованием
Стать партнером
Почему выбирают нас
Отзывы наших слушателей
Я узнала много нового для себя. Все материалы полезные и нужные. Занятия заставляли сосредоточиться, мобилизоваться. Вы провели полезные учебные курсы, которые нам были так необходимы. Много времени пришлось сидеть за компьютером, но цель оправдала средства.
Моргачева Татьяна Николаевна учитель МБОУ СОШ с. Тербуны
Обучение в ГАУДПО ИРО — это мой первый опыт дистанционного обучения, которым я очень довольн. Организация программы обучения на высоком уровне. Сайт очень удобный в использовании.
Организация программы обучения на высоком уровне. Сайт очень удобный в использовании.
Иванов Сергей Сергеевич МБОУ СОШ с Доброе
Я довольна организацией программы обучения, всё было в доступной и краткой форме, всё только самое основное, как говорится «без воды», это очень хорошо.
Петрова Валентина Ивановна Гимназия №19 г. Липецка
Авторы курсов повышения квалификации
Сотрудники института развития образования
Кафедра информатизации образования
Драганова Оксана Александровна
Кафедра педагогики и психологии
Аксёнова Инна Васильевна
Кафедра естественно-научного и математического образования
Максим Андреевич Крутиков
Кафедра информатизации образования
ГАУ ДПО Липецкой области «Институт развития образования»
© Кафедра информационно — технологического образования 2019.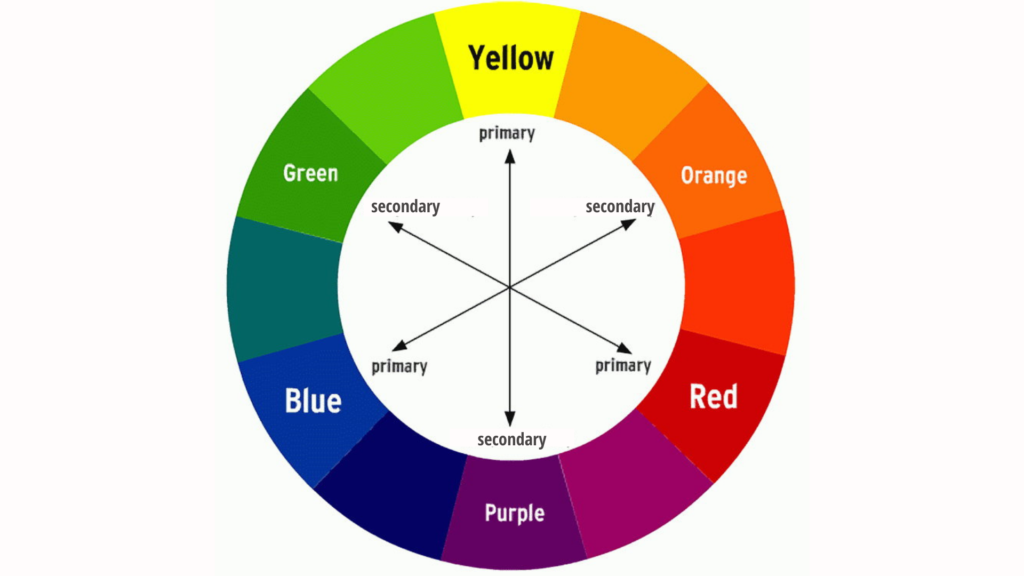
Цветовой круг — pro.bhub.com.ua
Содержание
-
1
Виды цветовых кругов
-
1.1
Цветовой круг И. Ньютона
-
1.2
Цветовой круг И. Гете
-
1.3
Цветовой круг И. Иттена
-
1.1
Цветовой круг И. Ньютона
-
2.
 1
Дополнительные цвета
1
Дополнительные цвета
-
2.
-
3
Теория цвета в практике мастера перманентного макияжа
Виды цветовых кругов
Цветовой круг И. Ньютона
Основоположник научного цветоведения И. Ньютон первым предложил реально существующий линейный спектр цветов для удобства изучения их взаимосвязей изображать в виде цветового круга. Цветовой круг И. Ньютона включал семь последовательно расположенных и радиально ориентированных секторов: красного, оранжевого, желтого, зеленого, голубого, синего и фиолетового цветов.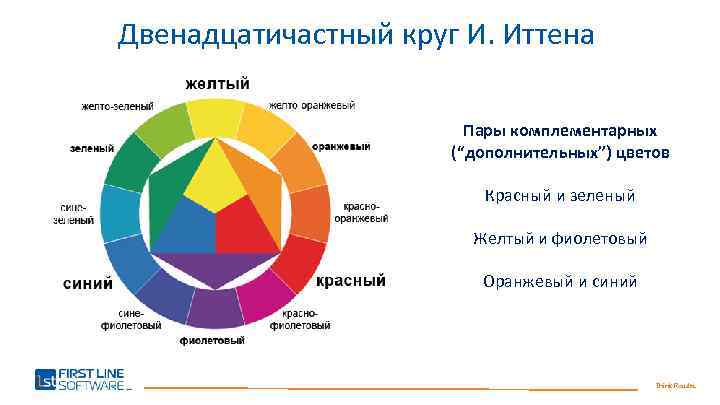 Цветовой круг И. Ньютона оказался очень удобным инструментом для расчета результатов смешения цветов.
Цветовой круг И. Ньютона оказался очень удобным инструментом для расчета результатов смешения цветов.
Впервые круговая конфигурация всех цветов спектра была предложена Исааком Ньютоном еще в 1666 году. Холодные цвета в его круге располагаются на одной стороне, теплые цвета — на противоположной; темные цвета располагаются напротив светлых.
Основная идея заключается в том, что любые два цвета на противоположных сторонах цветового круга взаимодействуют. Любые три цвета, равномерно распределенные в цветовом круге, тоже взаимодействуют. Можно использовать цветовой круг в качестве ориентира, чтобы помочь определить, какие цвета взаимодействуют, чтобы достичь своей цели.
Цветовой круг И. Гете
И. Гете предложил свою версию круга – 6-секторного. Его круг был образован тремя основными (по его мнению) цветами: красным, желтым и синим, располагающимися в углах равностороннего треугольника, между которыми находились цвета, получавшиеся в результате смешения фланкирующих их цветов: фиолетовым (между красным и синим), оранжевым (между желтым и красным) и зеленым (между желтым и синим).
Цветовой круг И. Иттена
Среди исследователей цвета на особом месте находится швейцарский художник и педагог Иоганнес Иттен, который сформулировал стройную концепцию сочетания оттенков и создал цветовой круг, до сих пор использующийся художниками, фотографами, а теперь – и мастерами перманентного макияжа.
Цветовой круг И. Иттена представляет собой фигуру из трех частей:
1. Треугольник в центре. Здесь расположены три цвета, которые Иттен считал основными: желтый, красный и синий. Все остальные оттенки – это лишь сочетание и смешение этих трех компонентов.
2. Шестиугольник, «достроенный» к треугольнику. В этой фигуре располагаются цвета второго порядка, полученные в результате попарного смешения основных цветов (все тех же желтого, красного и синего).
3. Круг, разделенный на 12 секторов. Те части окружности, на которые не указывают вершины треугольника и шестиугольника, содержат оттенки, получаемые путем смешения цветов из соседних секций.
Современная теория цвета
Традиционные цветовые круги имели практическое применение в живописи и были первой ненаучной попыткой объяснения того, как взаимодействуют красители. Так, по теории Гёте, цвета происходили от борьбы света и тьмы и первыми из этого столкновения появлялись цвета первого порядка — их называют первичными. Ими были красный (Red), жёлтый (Yellow) и синий (Blue) (RYB).
Современная теория цвета представлена несколькими цветовыми моделями и соответствующим им кругами — например, RGB (а также другими цветовыми моделями разработки CIE laboratory (например, LAB) и другими использующимися в промышленности для точного измерения цвета). В основе RGB лежит модель описания цветового пространства на базе опорных цветов: красный, зелёный и синий. Цветовой круг RGB заметно отличается от круга RYB цветовым охватом (в цветовой модели RYB, а так же цветовом круге RYB отсутствует существенная часть цветового охвата). Более того, в круге RYB представлены не дополнительные цвета, а так называемые «противоположные» или «комплементарные», как их определяет мистическая теория цвета Гёте.
Одним из следов системы RYB в культуре является популярное предубеждение, что красный и зелёный являются дополнительными цветами. В действительности, при аддитивном и субтрактивном синтезах красного и зелёного результирующие цвета не получаются ахроматическими.
Наиболее распространён восьми секторный цветовой круг RGB. Он включает 7 цветов радуги и пурпурный. Опорными цветами в этом круге считают красный, зелёный, голубой и добавляют к ним четыре «промежуточных» цвета (оранжевый, циановый, фиолетовый и пурпурный). В «ньютоновском» цветовом круге напротив располагаются дополнительные цвета. В цветовом круге RYB на равном растоянии друг от друга расположены чередующиеся первичные и цвета второго порядка — производные от цветов первого порядка. По предположению Гёте, сложение двух первичных цветов даёт вторичный цвет, расположенный между ними.
Цветовой круг в некоторых эстетических концепциях делят на тёплую и холодную половины. Тёплые цвета: красный, оранжевый, жёлтый и промежуточные оттенки.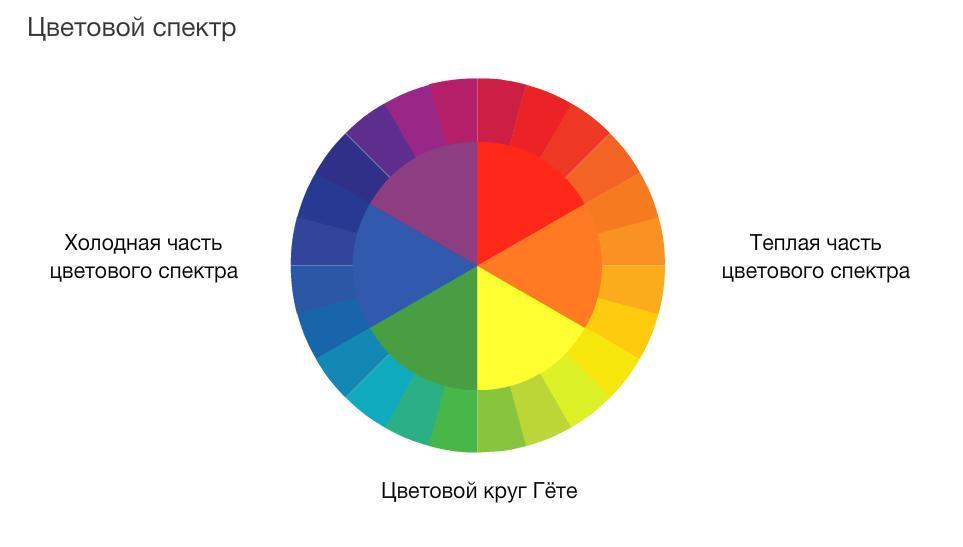 Холодные цвета: синий, циановый, зелёный, и переходные — сине-фиолетовый, сине-зелёный. Другие эстетические концепции предполагают, что бывают «холодный желтый», «теплый синий» и так далее.
Холодные цвета: синий, циановый, зелёный, и переходные — сине-фиолетовый, сине-зелёный. Другие эстетические концепции предполагают, что бывают «холодный желтый», «теплый синий» и так далее.
Дополнительные цвета
Пары цветов, расположенные на круге друг против друга, в круге RYB называются комплементарными (например, зелёный — красный, жёлтый — фиолетовый, синий — оранжевый), или дополнительными в физических системах RGB.
Дополнительные цвета при смешивании дают воспринимаемый ахроматический цвет.
Смешивание двух любых комплементарных цветов в равных пропорциях не даёт нейтральный серый тон (из за ограниченного цветового охвата RYB, наибольшая погрешность в зелено — красной паре RYB). Смешивание двух любых дополнительных цветов в равных пропорциях даёт нейтральный серый тон.
Дополнительный цвет стимулирует в восприятии смотрящего парный дополнительный и вызывает эффекты последовательного и симультанного контраста, но в силу физиологии восприятия цвета круг контрастных цветов немного отличается от круга дополнительных цветов. В части спектра пары дополнительных и контрастных цветов не совпадают.
В части спектра пары дополнительных и контрастных цветов не совпадают.
В цветовом круге не представлено ахроматических цветов, в том числе чёрного цвета.
Теория цвета в практике мастера перманентного макияжа
Теоретическое знание получения цвета абсолютно необходимо в работе мастера татуажа. При этом, необходимо знать не только, как цвета взаимодействуют друг с другом, но и то, как разные оттенки пигментов взаимодействуют с оттенками кожи или с цветом пигмента, уже находящегося в коже.
Три основных цвета — красный, желтый и синий, являются базовыми цветами, которые не могут быть получены путем смешения любых других цветов. Цвета второго порядка — это цвета, полученные путем смешения основных цветов. Цвета третьего порядка — это цвета, полученные путем смешения основных цветов и цветов второго порядка.
Цвета, полученные смешиванием черного и белого, не рассматриваются как истинные оттенки, но используются для изменения значения светлоты цвета.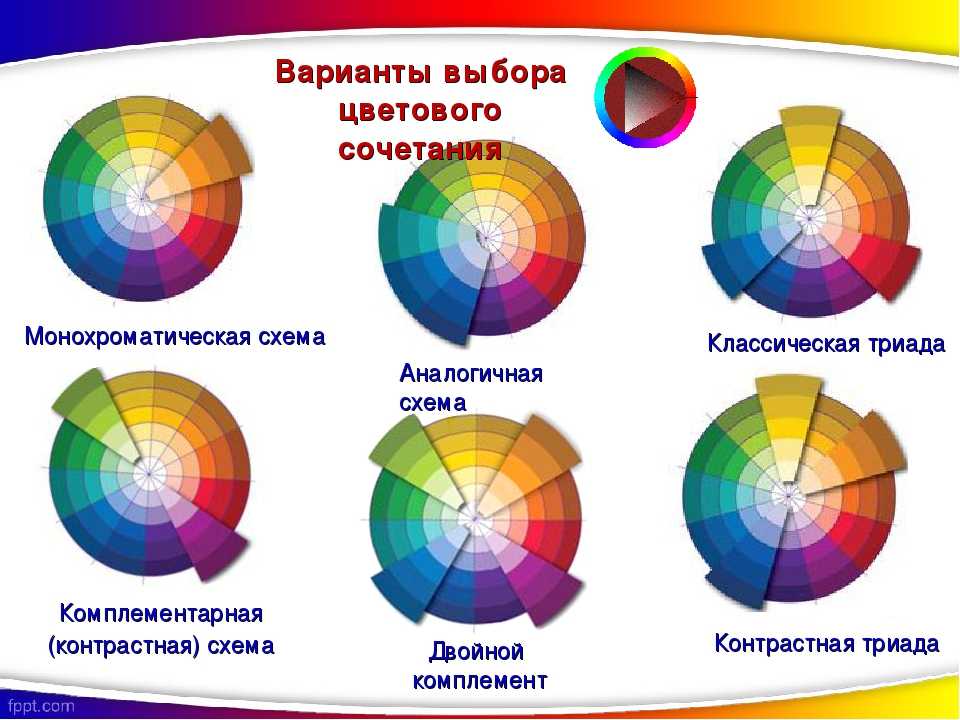
цветовой круг, цветовой круг иттена, цветовой круг онлайн, цветовой круг колориста, цветовой круг как пользоваться, цветовой круг колористика, цветовой круг сочетание цветов, цветовой круг стилиста, цветовой круг сочетания цветов
Другие материалы по теме
Колористика
Колористика — наука о цвете, включающая знания о природе цвета, основных, составных и дополнительных цветах, основных характеристиках цвета, цветовых контрастах, смешении цветов и цветовых гармониях, цветовом языке и цветовой культуре, а также искусство сочетания цветов.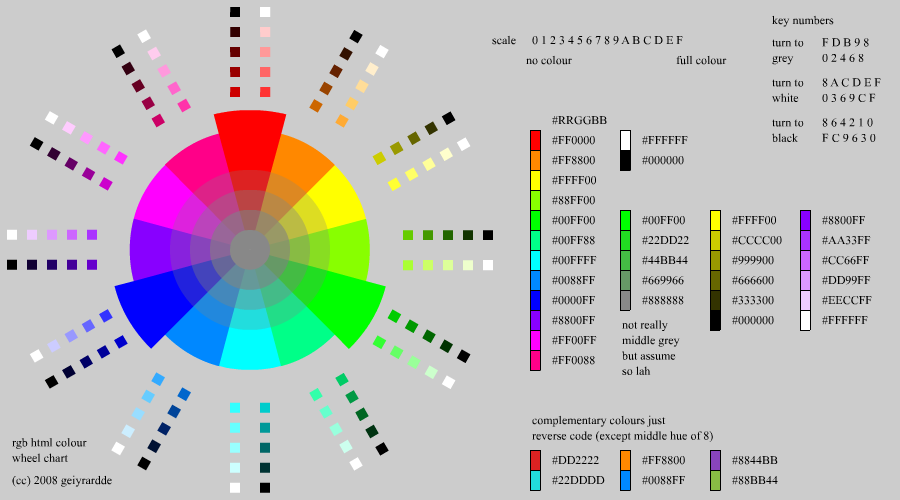
Цветовой круг Цветовой круг — способ представления цветов видимого спектра в условной форме, обозначающей различные цветовые модели. Секторы круга представляют определяемые цвета, размещённые в порядке условно близком к расположению в спектре видимого света. Как правило, цвета, представленные в круге, — это условные цвета максимальной цветовой насыщенности, выбранные из поля цветового охвата цветовой модели. Классификация цветов в определенном порядке, с использованием цветового тона, светлоты, насыщенности получила название цветовой системы. Сегодня существуют различные виды цветовых систем (известно около 47 систем цвета), начиная от обычных цветовых кругов, атласов, шкал, вееров, цифровых таблиц, объемно-пространственных цветовых систем до современных цветовых пантонов.
13.
 20: Видимый спектр и цвет
20: Видимый спектр и цвет
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16354
На этой странице объясняется, что происходит, когда органические соединения поглощают ультрафиолетовый или видимый свет, и почему длина волны поглощаемого света варьируется от соединения к соединению.
Что происходит, когда свет поглощается молекулами?
Когда мы говорили о различных видах орбиталей, присутствующих в органических соединениях на вводной странице (см. выше), вы наткнулись на эту диаграмму, показывающую их относительную энергию:
Помните, что диаграмма не предназначена для быть в масштабе — он просто показывает относительное расположение различных орбиталей. Когда свет проходит через соединение, энергия света используется для продвижения электрона со связывающей или несвязывающей орбитали на одну из пустых антисвязывающих орбиталей. Возможные скачки электронов, которые может вызвать свет:
Когда свет проходит через соединение, энергия света используется для продвижения электрона со связывающей или несвязывающей орбитали на одну из пустых антисвязывающих орбиталей. Возможные скачки электронов, которые может вызвать свет:
В каждом возможном случае электрон переходит с полной орбитали на пустую антисвязывающую орбиталь. Каждый прыжок забирает энергию у света, а для большого прыжка явно требуется больше энергии, чем для маленького. С каждой длиной волны света связана определенная энергия. Если это конкретное количество энергии как раз подходит для одного из этих энергетических скачков, то эта длина волны будет поглощена — ее энергия будет использована для продвижения электрона.
Нам нужно выяснить, какова связь между энергетической щелью и поглощаемой длиной волны. Означает ли, например, большая энергетическая щель, что свет с меньшей длиной волны будет поглощаться — или что? Легче начать с отношения между частотой поглощенного света и его энергией:
Как видите, если вы хотите совершить прыжок с высокой энергией, вам придется поглощать свет более высокой частоты. Чем больше частота, тем больше энергия. Это просто, но, к сожалению, спектры поглощения УФ-видимого диапазона всегда даются с использованием длин волн света, а не частоты. Это означает, что вам нужно знать соотношение между длиной волны и частотой.
Чем больше частота, тем больше энергия. Это просто, но, к сожалению, спектры поглощения УФ-видимого диапазона всегда даются с использованием длин волн света, а не частоты. Это означает, что вам нужно знать соотношение между длиной волны и частотой.
Отсюда видно, что чем выше частота, тем меньше длина волны. Итак, если у вас больший энергетический скачок, вы будете поглощать свет с более высокой частотой — это то же самое, что сказать, что вы будете поглощать свет с более низкой длиной волны.
Важное резюме: чем больше скачок энергии, тем меньше длина волны поглощаемого света.
Некоторые скачки важнее других для абсорбционной спектрометрии
Абсорбционный спектрометр работает в диапазоне от примерно 200 нм (в ближнем ультрафиолетовом диапазоне) до примерно 800 нм (в самом ближнем инфракрасном диапазоне). Только ограниченное число возможных скачков электрона поглощает свет в этой области. Посмотрите еще раз на возможные прыжки. На этот раз важные прыжки показаны черным, а менее важные — серым. Серые пунктирные стрелки показывают скачки, поглощающие свет за пределами области спектра, в которой мы работаем.
На этот раз важные прыжки показаны черным, а менее важные — серым. Серые пунктирные стрелки показывают скачки, поглощающие свет за пределами области спектра, в которой мы работаем.
Помните, что большие прыжки требуют больше энергии и поэтому поглощают свет с более короткой длиной волны. Скачки, показанные серыми пунктирными стрелками, поглощают УФ-свет с длиной волны менее 200 нм. Важными прыжками являются:
- с пи-связывающих орбиталей на пи-разрыхляющие орбитали;
- с несвязывающих орбиталей на пи-антисвязывающие орбитали;
- с несвязывающих орбиталей на сигма-антисвязывающие орбитали.
Это означает, что для поглощения света в области от 200 до 800 нм (где измеряются спектры) молекула должна содержать либо пи-связи, либо атомы с несвязывающими орбиталями. Помните, что несвязывающая орбиталь — это неподеленная пара, скажем, кислорода, азота или галогена.
Группы в молекуле, поглощающие свет, известны как хромофоры.

Как выглядит спектр поглощения
На приведенной ниже диаграмме показан простой спектр поглощения в УФ-видимой области для бута-1,3-диена — молекулы, о которой мы поговорим позже. Поглощение (по вертикальной оси) — это всего лишь мера количества поглощенного света. Чем выше значение, тем большая часть определенной длины волны поглощается.
Вы увидите, что пик поглощения приходится на значение 217 нм. Это в ультрафиолете, поэтому не будет никаких видимых признаков поглощения света — бута-1,3-диен бесцветен. Вы читаете символ на графике как «лямбда-макс». В бута-1,3-диене CH 2 =CH-CH=CH 2 , несвязывающих электронов нет. Это означает, что единственные скачки электронов (в пределах диапазона, который может измерить спектрометр) происходят с пи-связывающих на пи-разрыхляющие орбитали.
Хромофор, дающий два пика
Хромофор, такой как углерод-кислородная двойная связь в этанале, например, очевидно имеет пи электронов как часть двойной связи, но также имеет неподеленные пары на атоме кислорода. Это означает, что возможны оба важных поглощения из последней энергетической диаграммы. Вы можете возбудить электрон с пи-связи на антисвязывающую пи-орбиталь, или вы можете возбудить электрон с неподеленной пары кислорода (несвязывающая орбиталь) на антисвязывающую пи-орбиталь.
Это означает, что возможны оба важных поглощения из последней энергетической диаграммы. Вы можете возбудить электрон с пи-связи на антисвязывающую пи-орбиталь, или вы можете возбудить электрон с неподеленной пары кислорода (несвязывающая орбиталь) на антисвязывающую пи-орбиталь.
Несвязывающая орбиталь имеет более высокую энергию, чем пи-связывающая орбиталь. Это означает, что для перехода с неподеленной пары кислорода на антисвязывающую пи-орбиталь требуется меньше энергии. Это означает, что он поглощает свет более низкой частоты и, следовательно, более высокой длины волны. Таким образом, этаналь может поглощать свет с двумя разными длинами волн:
- пики поглощения пи-связи с пи-анти-связью при 180 нм;
- несвязывающиеся пики антисвязывающего поглощения пи при 290 нм.
Оба этих поглощения относятся к ультрафиолетовому излучению, но большинство спектрометров не улавливают поглощение при 180 нм, потому что они работают в диапазоне 200–800 нм.
Важность конъюгации и делокализации
Рассмотрим эти три молекулы:
Этен содержит простую изолированную углерод-углеродную двойную связь, а две другие имеют сопряженные двойные связи. В этих случаях происходит делокализация пи-орбиталей по всей молекуле. Теперь посмотрите на длины волн света, которые поглощает каждая из этих молекул.
| молекула | длина волны максимального поглощения (нм) |
|---|---|
| этен | 171 |
| бута-1,3-диен | 217 |
| гекса-1,3,5-триен | 258 |
Все молекулы дают схожие спектры поглощения в УФ-видимой области с той лишь разницей, что поглощение смещается в сторону все более и более длинных волн по мере увеличения степени делокализации в молекуле.
Почему это? Вы действительно можете понять, что должно происходить.
- Максимальное поглощение смещается в сторону более длинных волн по мере увеличения степени делокализации.
- Следовательно, максимальное поглощение смещается к более коротким частотам по мере увеличения степени делокализации.
- Следовательно, поглощение требует меньше энергии по мере увеличения степени делокализации.
- Следовательно, должна быть меньшая энергетическая щель между связывающими и разрыхляющими орбиталями по мере увеличения степени делокализации.
. . . и это то, что происходит.
Сравните этен с бута-1,3-диеном. В этене есть одна связывающая пи орбиталь и одна антисвязывающая пи орбиталь. В бута-1,3-диене есть две пи-связывающие орбитали и две пи-разрыхляющие орбитали. Все это подробно обсуждается на вводной странице, которую вы должны были прочитать.
Высшую занятую молекулярную орбиталь часто называют ВЗМО — в этих случаях это пи-связывающая орбиталь. Самая нижняя незанятая молекулярная орбиталь (НСМО) представляет собой антисвязывающую пи-орбиталь. Обратите внимание, что разрыв между ними сократился. Для возбуждения электрона в случае бута-1,3-диена требуется меньше энергии, чем в случае этилена.
Самая нижняя незанятая молекулярная орбиталь (НСМО) представляет собой антисвязывающую пи-орбиталь. Обратите внимание, что разрыв между ними сократился. Для возбуждения электрона в случае бута-1,3-диена требуется меньше энергии, чем в случае этилена.
В случае гекса-1,3,5-триена еще меньше.
Если вы распространите это на соединения с действительно массивной делокализацией, поглощенная длина волны в конечном итоге станет достаточно высокой, чтобы оказаться в видимой области спектра, и тогда соединение будет восприниматься как окрашенное. Хорошим примером этого является пигмент оранжевого растения, бета-каротин, присутствующий, например, в моркови.
Почему бета-каротин оранжевый?
Бета-каротин имеет тип делокализации, который мы только что рассмотрели, но в гораздо большем масштабе с 11 двойными углерод-углеродными связями, сопряженными вместе. На диаграмме показана структура бета-каротина с чередующимися двойными и одинарными связями, показанными красным цветом.
Чем больше делокализация, тем меньше разрыв между связывающей пи-орбиталью с самой высокой энергией и разрыхляющей пи-орбиталью с наименьшей энергией. Следовательно, для продвижения электрона в бета-каротине требуется меньше энергии, чем в случаях, которые мы рассматривали до сих пор, потому что зазор между уровнями меньше.
Помните, что меньшее количество энергии означает поглощение более низкой частоты света, что эквивалентно большей длине волны. Бета-каротин поглощает весь ультрафиолетовый диапазон в фиолетовый, но особенно сильно в видимом диапазоне между 400 и 500 нм с пиком около 470 нм. Если вы читали страницу в этом разделе об электромагнитном излучении, вы, возможно, помните, что длины волн, связанные с различными цветами, примерно равны:
| цветовая область | длина волны (нм) |
|---|---|
| фиолетовый | 380 — 435 |
| синий | 435 — 500 |
| голубой | 500 — 520 |
| зеленый | 520 — 565 |
| желтый | 565 — 590 |
| оранжевый | 590 — 625 |
| красный | 625 — 740 |
Итак, если поглощение наиболее сильно в диапазоне от фиолетового до голубого, какой цвет вы на самом деле увидите? Соблазнительно думать, что вы можете вычислить его по оставшимся цветам — и в этом конкретном случае вы не сильно ошибетесь. К сожалению, это не так просто!
К сожалению, это не так просто!
Иногда то, что вы видите на самом деле, совершенно неожиданно. Смешивание различных длин волн света не дает такого же результата, как смешивание красок или других пигментов. Однако иногда вы можете получить некоторую оценку цвета, который вы увидите, используя идею дополнительных цветов.
Дополнительные цвета
Если расположить несколько цветов по кругу, получится «цветовой круг». На схеме показан один из возможных вариантов этого. Поиск в интернете выдаст много разных версий!
цвета, расположенные напротив друг друга на цветовом круге, называются дополнительными цветами. Синий и желтый — дополнительные цвета; красный и голубой дополняют друг друга; а также зеленый и пурпурный. Смешивание двух дополнительных цветов света даст вам белый свет.
Все это означает, что если определенный цвет поглощается из белого света, то, что ваш глаз определяет, смешивая все другие длины волн света, является его дополнительным цветом.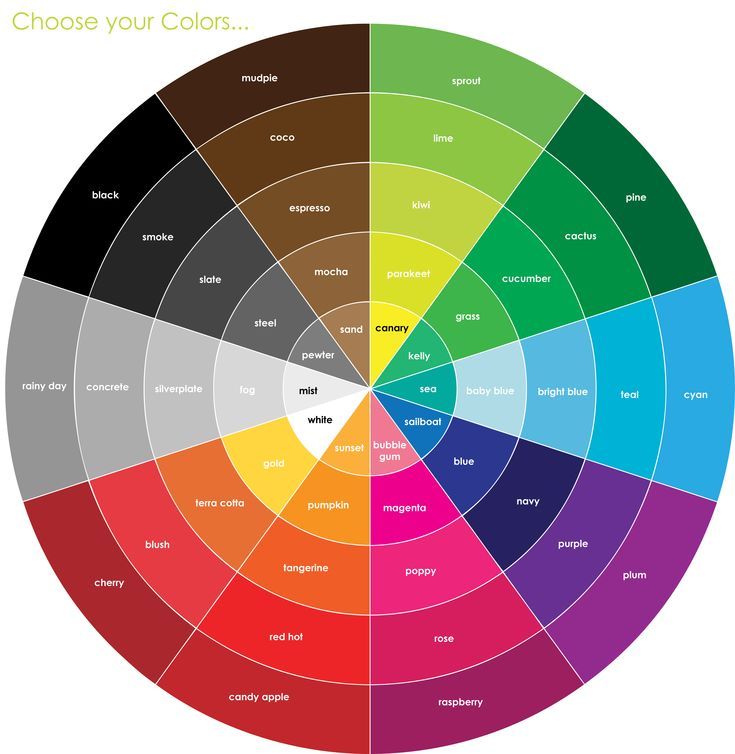 В случае с бета-каротином ситуация более запутанная, потому что вы поглощаете такой диапазон длин волн. Однако, если вы думаете о пике поглощения, идущем от синего к голубому, было бы разумно думать о цвете, который вы увидите, как о противоположном тому, где желтый переходит в красный, другими словами, об оранжевом.
В случае с бета-каротином ситуация более запутанная, потому что вы поглощаете такой диапазон длин волн. Однако, если вы думаете о пике поглощения, идущем от синего к голубому, было бы разумно думать о цвете, который вы увидите, как о противоположном тому, где желтый переходит в красный, другими словами, об оранжевом.
Применив это к изменению цвета двух индикаторов
Фенолфталеин
Вы, вероятно, использовали фенолфталеин в качестве кислотно-щелочного индикатора и знаете, что он бесцветен в кислых условиях и пурпурный (ярко-розовый) в щелочном растворе. . Как это изменение цвета связано с изменениями в молекуле? Структуры двух разноцветных форм:
Обе они поглощают свет в ультрафиолетовом диапазоне, но тот, что справа, также поглощает в видимом диапазоне с пиком на 553 нм. Молекула в растворе кислоты бесцветна, потому что наши глаза не могут обнаружить тот факт, что часть света поглощается в ультрафиолетовом диапазоне. Однако наши глаза обнаруживают поглощение при 553 нм, производимое формой в щелочном растворе.
553 нм находится в зеленой области спектра. Если вы посмотрите на цветовой круг, вы обнаружите, что дополнительный цвет зеленого — пурпурный — и именно этот цвет вы видите.
Так почему цвет меняется при изменении структуры? То, что мы имеем, является сдвигом к поглощению на более высокой длине волны в щелочном растворе. Как мы уже видели, сдвиг в сторону большей длины волны связан с большей степенью делокализации.
Вот модифицированная схема строения формы в кислом растворе — бесцветная форма. Степень делокализации показана красным цветом.
Обратите внимание, что есть делокализация по каждому из трех колец, распространяющаяся на двойную связь углерод-кислород и на различные атомы кислорода из-за их неподеленных пар.
Но делокализация не распространяется на всю молекулу. Атом углерода в центре с его четырьмя одинарными связями предотвращает взаимодействие трех делокализованных областей друг с другом.
Теперь сравните это с пурпурной формой:
Теперь перегруппировка позволяет делокализации распространиться на весь ион. Эта большая делокализация уменьшает энергетический разрыв между самой высокой занятой молекулярной орбиталью и самой низкой незанятой антисвязывающей пи-орбиталью. Чтобы совершить прыжок, требуется меньше энергии, поэтому поглощается более длинная длина волны света.
Эта большая делокализация уменьшает энергетический разрыв между самой высокой занятой молекулярной орбиталью и самой низкой незанятой антисвязывающей пи-орбиталью. Чтобы совершить прыжок, требуется меньше энергии, поэтому поглощается более длинная длина волны света.
Увеличение степени делокализации сдвигает пик поглощения в сторону большей длины волны.
Метиловый апельсин
Вы знаете, что метиловый апельсин в щелочных растворах желтый, а в кислых — красный. Структура в щелочном растворе:
В кислом растворе ион водорода (возможно, неожиданно) присоединен к одному из атомов азота в двойной связи азот-азот.
Теперь все становится намного сложнее! Положительный заряд азота делокализован (распределен по всей структуре) — особенно к правому концу молекулы, как мы написали. Обычно нарисованная структура красной формы метилового оранжевого выглядит так. . .
Но это может ввести в заблуждение в отношении степени делокализации в структуре по причинам, обсуждаемым ниже (после красного предупреждающего прямоугольника), если вам интересно.
Какая структура более делокализована?
Давайте обратимся к спектрам поглощения, чтобы посмотреть, поможет ли это. Желтая форма имеет пик поглощения около 440 нм. Это находится в синей области спектра, а дополнительный цвет синего — желтый. Это именно то, что вы ожидаете. Красная форма имеет пик поглощения около 520 нм. Это край голубой области спектра, а дополнительный цвет голубого — красный. Опять же, здесь нет ничего неожиданного.
Обратите внимание, что переход от желтой формы к красной привел к увеличению поглощаемой длины волны. Увеличение длины волны предполагает увеличение делокализации. Это означает, что в красной форме должно быть больше делокализации, чем в желтой. Вот снова структура желтой формы:
Делокализация будет распространяться на большую часть структуры — вплоть до неподеленной пары на правом атоме азота.
Если вы используете нормально написанную структуру для красной формы, делокализация кажется нарушенной посередине — кажется, что картина чередования одинарных и двойных связей потеряна.
Но это означает неправильное понимание того, что представляет эта последняя структура.
Канонические формы
Если вы нарисуете две возможные структуры Кекуле для бензола, вы поймете, что реальная структура бензола не похожа ни на одну из них. Реальная структура находится где-то посередине — все связи идентичны и по характеру находятся где-то между одинарными и двойными. Это из-за делокализации в бензоле.
Эти две структуры известны как канонические формы, и каждую из них можно рассматривать как добавление некоторого знания к реальной структуре. Например, связь в правом верхнем углу молекулы не является ни одинарной, ни двойной, а находится где-то посередине. Аналогично со всеми остальными облигациями.
Две структуры, которые мы ранее нарисовали для красной формы метилового оранжевого, также являются каноническими формами — две из множества форм, которые можно было бы нарисовать для этой структуры. Мы могли бы представить делокализованную структуру как:
Эти две формы можно рассматривать как результат движения электронов в структуре, и фигурные стрелки часто используются, чтобы показать, как одна структура может привести к другой.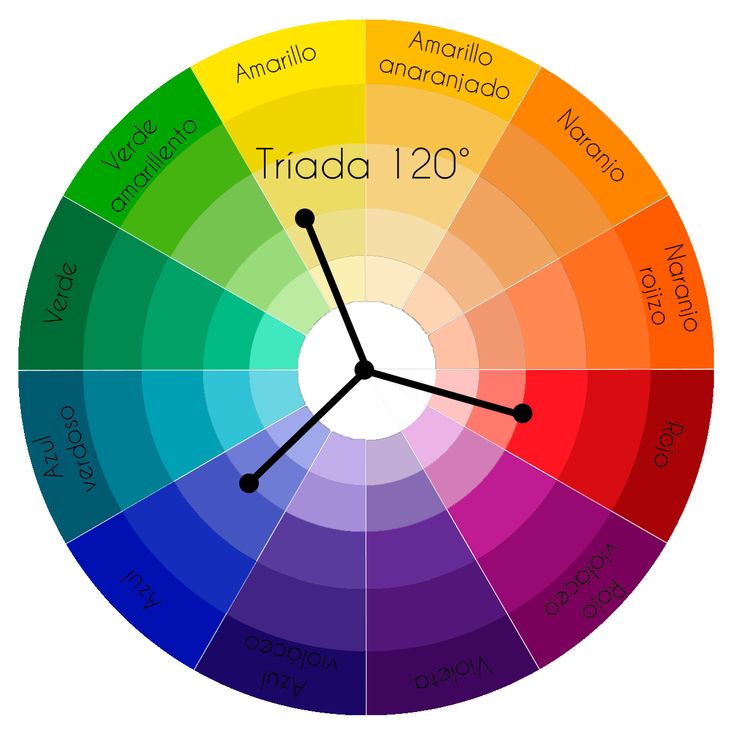
На самом деле электроны не сдвинулись полностью ни в ту, ни в другую сторону. Как и в случае с бензолом, фактическая структура находится где-то посередине.
Вы также должны понимать, что рисование канонических форм не влияет на основную геометрию конструкции. Типы связей, длины или углы не меняются в реальной структуре.
Например, неподеленные пары атомов азота, показанные на последней диаграмме, участвуют в делокализации. Чтобы это произошло, все связи вокруг этих атомов азота должны быть в одной плоскости, а неподеленная пара торчит вверх, чтобы она могла перекрываться вбок с орбиталями соседних атомов. Тот факт, что в каждой из двух канонических форм один из этих атомов азота показан так, как если бы он имел аммиакоподобное расположение связей, потенциально вводит в заблуждение и создает впечатление, что делокализация нарушена.
Проблема в том, что нет простого способа представить сложную делокализованную структуру на простых структурных схемах. С бензолом и так плохо — с чем-то таким сложным, как метиловый оранжевый, любой метод просто приводит к возможной путанице, если вы не привыкли работать с каноническими формами.
С бензолом и так плохо — с чем-то таким сложным, как метиловый оранжевый, любой метод просто приводит к возможной путанице, если вы не привыкли работать с каноническими формами.
Все становится еще сложнее! Если бы вы делали это правильно, то было бы множество других канонических форм с различным расположением двойных и одинарных связей и с положительным зарядом, расположенным в разных местах вокруг колец и на другом атоме азота.
Реальная структура не может быть представлена должным образом ни одной из множества канонических форм, но каждая дает намек на то, как работает делокализация.
Если мы возьмем две формы, которые мы записали, как, возможно, две наиболее важные, это предполагает, что имеет место делокализация электронов по всей структуре, но что электронная плотность немного ниже вокруг двух атомов азота, несущих положительный заряд на ту или иную каноническую форму.
Почему красная форма более делокализована
Наконец, мы приступаем к попытке объяснить, почему делокализация больше у красной формы метилового оранжевого в кислом растворе, чем у желтой в щелочном растворе. Ответ может заключаться в том факте, что неподеленная пара азота на правом конце структуры, как мы ее нарисовали, более полно участвует в делокализации в красной форме. Каноническая форма с положительным зарядом этого азота предполагает значительное движение этой неподеленной пары к остальной части молекулы.
Ответ может заключаться в том факте, что неподеленная пара азота на правом конце структуры, как мы ее нарисовали, более полно участвует в делокализации в красной форме. Каноническая форма с положительным зарядом этого азота предполагает значительное движение этой неподеленной пары к остальной части молекулы.
Не происходит ли то же самое с неподеленной парой на том же азоте в желтой форме метилового оранжевого? Не до такой же степени.
Любая каноническая форма, которую вы рисуете, в которой это происходит, создает еще один отрицательно заряженный атом где-то в остальной части структуры. Такое разделение отрицательных и положительных зарядов энергетически невыгодно. В красной форме мы не производим нового разделения зарядов — просто перемещаем положительный заряд по структуре.
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

-
- Теги
-
Цвет
|
Содержимое
|
Светопоглощение
Когда молекула взаимодействует со светом и энергия поглощается, говорят, что молекула возбуждается, и происходит переход, который может перевести молекулу из начального состояния в состояние с более высокой энергией.
В одноэлектронном приближении это описывается продвижением электрона с заполненной орбитали на незаполненную орбиталь (в случае диамагнетиков). Разница в энергии между этими уровнями (возбужденное состояние и основное состояние) дает энергию фотонов, которые могут быть поглощены.
Для характеристики этого перехода можно использовать несколько параметров, включая энергию падающего излучения, необходимую для эффективного поглощения света, и присущую молекулам способность поглощать излучение с соответствующей энергией по соотношению Планка:
где hv — энергия фотона, соответствующая энергетической щели между состояниями. Энергия указывается в нескольких единицах; следующее полезно для перевода между некоторыми распространенными единицами, которые встречаются в литературе:
1 эВ = 23,06 ккал/моль = 8065 см -1 = 1240 нм
Цвет
Наше восприятие цвета определяется тем, какие длины волн излучения достигают нашего глаза, и чувствительностью рецепторов нашего глаза к различным цветам. В глазу есть палочки и колбочки, содержащие хромофоры, которые преобразуют свет в электрический импульс, который мозг использует для восприятия изображений. Это противоположно тому, что вы видите в светоизлучающих диодах, в которых электричество вызывает излучение света.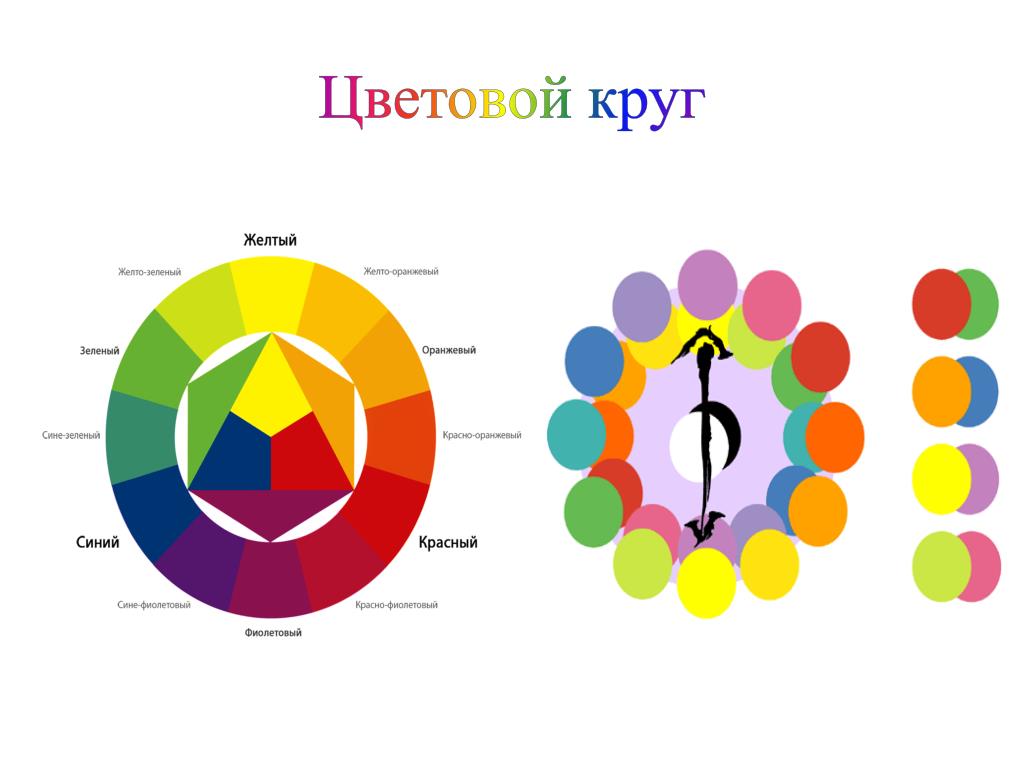
Палочки функционируют в условиях низкой интенсивности и дают изображения в оттенках черного, серого и белого. Это называется скотопическим зрением.
Колбочки обрабатывают изображения высокой интенсивности цвета, что называется фотопическим зрением. Колбочки бывают трех видов, которые примерно соответствуют синей, зеленой и красной чувствительности; если одновременно возбуждаются все три колбочки, то изображение будет белым.
Дополнительные цвета
На этом рисунке показано, какой цвет будет восприниматься, когда материал поглощает свет в определенных областях видимого спектра.
Если длина волны света из определенной области спектра поглощается материалом, то материалы будут иметь дополнительный цвет. Так, например, если поглощается фиолетовый свет с длиной волны 400 нм, материал будет выглядеть желтым. Если материал поглощает синий цвет, вы увидите оранжевый цвет.
| Поглощенный цвет | Видимый цвет |
|---|---|
| Фиолетовый | Желтый |
| Синий | Оранжевый |
| Зеленый | Красный |
| Желтый | Фиолетовый |
| Оранжевый | Синий |
Обратите внимание, что зеленый цвет на рисунке не обозначен; это связано с тем, что материалы, которые кажутся зелеными, на самом деле поглощают красную и синюю (т. Е. Около 650 нм и 425 нм) полосу формы и цвета.
Е. Около 650 нм и 425 нм) полосу формы и цвета.
Наша способность воспринимать очень небольшие различия в цвете довольно экстраординарна; например, два раствора, которые, по-видимому, имеют практически идентичные спектры поглощения с незначительными различиями в их хвостах, могут быть распознаны как явно разные оттенки. Очень небольшие изменения в форме полосы поглощения (не только положения) приведут к тому, что материалы будут иметь разные оттенки.
Яркий и тусклый
Резкий пик поглощения приводит к восприятию насыщенного цвета.
Как правило, цвета, которые мы воспринимаем как блестящие и яркие, имеют сильные узкие полосы поглощения, тогда как тусклые цвета, как правило, имеют более слабые и широкие полосы поглощения.
Цвет Описание
Оттенок — это тот аспект цвета, который обычно ассоциируется с такими терминами, как красный, оранжевый, желтый и т. д. Оттенок отличает чистоту цвета доминирующего цвета (т.![]() е. красный от желтого). Положение максимумов поглощения во многом определяет это свойство.
е. красный от желтого). Положение максимумов поглощения во многом определяет это свойство.
насыщенность (также известная как цветность или тон) относится к относительной чистоте; когда чистый, яркий, сильный оттенок красного смешивается с переменным количеством белого, получаются более слабые или бледные красные оттенки, каждый из которых имеет одинаковый оттенок, но разную насыщенность; такие более бледные цвета называются ненасыщенными цветами. Вы можете определить степень насыщенности данного с помощью диаграммы цветности. Например, предположим, что у вас есть красный цвет, и вы медленно увеличиваете количество синего и зеленого света, достигающего глаза, тогда смесь красного, синего и зеленого будет способствовать восприятию белого. Белый плюс красный дали бы розовый. Оттенок не изменился бы, но насыщенность была бы ниже
Свет любой заданной комбинации оттенка и насыщенности может иметь переменную яркость (также называемую интенсивностью, яркостью или значением), которая зависит от общего количества присутствующей световой энергии.
